症例が見つからなかった遺伝性腎疾患と そのバイオマーカーを発見
腎臓内科学とマトリックスバイオロジーのmissing pieceが大阪から
研究成果のポイント
- 基礎研究で重要性が指摘されながら、長らく症例が見つからなかったラミニンα5鎖遺伝子ヘテロ変異を有する家族性巣状分節性糸球体硬化症を発見した。
- 若年発症の蛋白尿、緩徐な腎機能低下、肺気腫性病変という新しい疾患の病態が明らかとなった。
- 本疾患の遺伝子改変モデルマウスを作成し、詳しく疾患メカニズムを解析する過程で、病変組織にビンキュリン蛋白の発現が増強することを見出し、ビンキュリンが疾患のバイオマーカーとして診断に役立つ可能性がある。
概要
大阪大学大学院医学系研究科の貝森淳哉 寄附講座准教授(腎疾患臓器連関制御学)、猪阪善隆 教授(腎臓内科学)、東京薬科大学薬学部の吉川大和 准教授(病態生化学)らの研究グループは、共同でラミニンα5鎖遺伝子ヘテロ変異を有する家族性巣状分節性糸球体硬化症(FSGS)の症例を世界で初めて発見しました。これまで細胞を支える基底膜の構成蛋白であるラミニンα5鎖は、腎臓の糸球体にとって重要な役割をしていると考えられていましたが、ラミニンα5鎖を原因とする腎疾患がどのようになるのかについては十分に解明されていませんでした。この新しい疾患では、若年発症の持続性蛋白尿、緩徐な腎機能低下、胸痛を伴う肺気腫病変を発症することが明らかとなりました。また、病変部位にビンキュリンという蛋白が増加することが認められ、ビンキュリンをバイオマーカーとして用いることで、この疾患を簡便に診断できる可能性があることを示しました。
今回、研究グループは、実際に診察した家族性FSGSの患者さんの協力を得て、ゲノムDNAを解析することによりラミニンα5鎖遺伝子の新しい遺伝子変異を発見し、同じ遺伝子変異をもつマウスを作成して解析することで、この病態を解明しました。これにより、腎糸球体疾患の診断がより進歩し、腎疾患の更なる病態解明、治療法の確立が期待されます。
本研究成果は、米国科学誌「JCI Insight」に、9月29日(木)(日本時間)に公開されました。
研究の背景
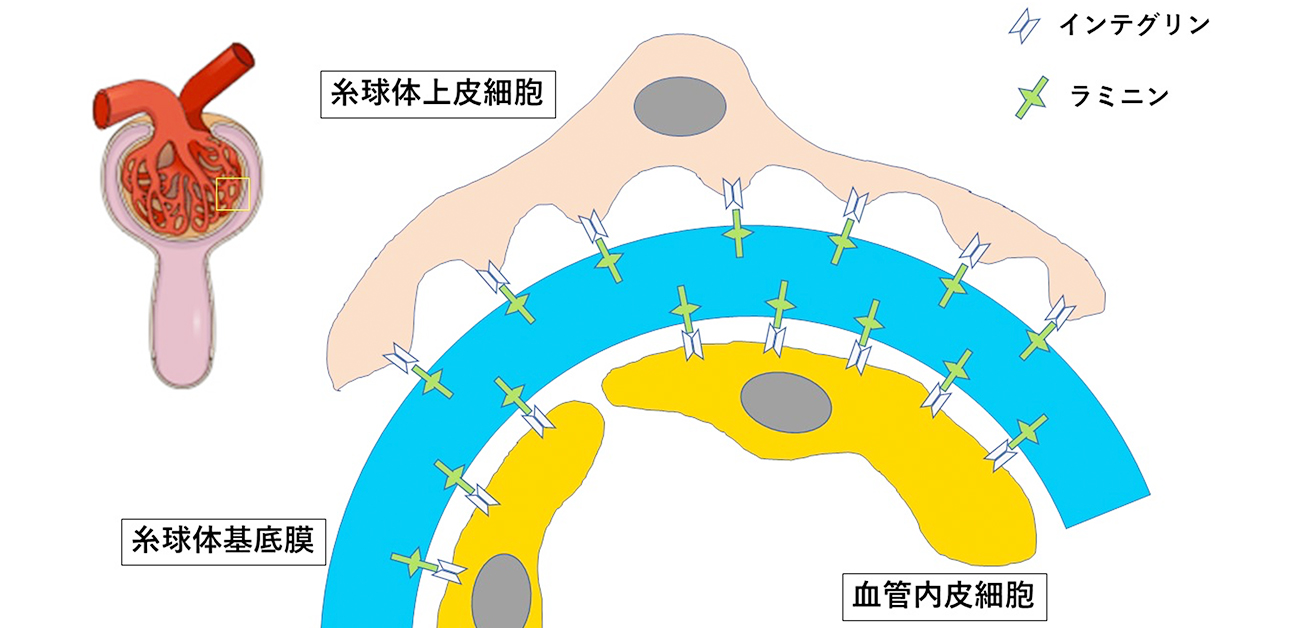
腎臓が働かなくなる、人工透析が必要な患者さんの数は、年々増加の一途をたどり、国民の医療費を圧迫しています。しかしながら、透析につながる腎疾患の病態に関しては良くわかっていないことも多く、診断が出来ない例も多くあります。腎臓は、糸球体と呼ばれるフィルターを用いて、血液をろ過して尿を作ります。糸球体の重要な構成要素のひとつが、糸球体基底膜です。糸球体基底膜は、糸球体というフィルターの物理的な構成要素としてだけでなく、隣接する細胞の足場の働きもしています。特に、ラミニンα5鎖は細胞に足場を与える重要な役割を担っており(図1)、マウスを用いた基礎研究により糸球体の働きに必須な分子であることが証明されてきました。しかしながら、これまで実際にラミニンα5鎖が原因となる遺伝性疾患の例は数少なく、発生に異常がある小児のホモ変異症例(対立遺伝子の両方に変異がある場合)に限られていました。成人では、FSGSを伴う腎症に、ラミニンα5鎖遺伝子のヘテロ変異(対立遺伝子の一方に変異がある場合)を発見したという報告がありました。しかしながら、最近の研究により、報告されたラミニンα5鎖遺伝子のヘテロ変異が腎疾患を引き起こさないのではないかとも言われています。このため、ラミニンα5鎖遺伝子のヘテロ変異を原因とする遺伝性腎疾患が人間の病気として存在するのかという問題が、解かれぬ謎として残っていました。
図1. 糸球体の構造(糸球体基底膜上にインテグリンーラミニンの結合により、細胞が固定されている)
研究の内容
今回、研究グループは、実際に診察を行った、FSGSを伴う家族性腎疾患の患者さんに協力を頂き、家族3名のゲノム遺伝子を用いて、全エクソームシークエンス解析を行い、ラミニンα5鎖遺伝子の新規ヘテロ変異p.V3687Mを発見しました。この遺伝子変異が本当にこの疾患を引き起こすかを証明するため、同じ遺伝子変異をもつ、遺伝子改変マウスを作成し、病態を解析したところ、生後72週目で尿蛋白陽性、FSGS病変、肺気腫の変化及び気管支の変形を認め(図2)、マウスでも同じ遺伝子変異がヒトと同様の疾患を引き起こすことを示しました。また、この遺伝子改変マウスの病態を詳しく解析した結果、変異をもつラミニンα5鎖蛋白の基底膜への分泌が減少し(図2)、細胞の接着の低下が、本疾患の原因になっていると示唆されました。また、細胞接着と関係するビンキュリン蛋白の病変での増加が認められ、この蛋白の増加が本疾患のバイオマーカーとして診断に応用できる可能性が示唆されました。
図2. 本疾患の病態の特徴(ラミニンα5鎖の分泌減少、ビンキュリンの増加、肺気腫性変化及び気管変形)
本研究成果が社会に与える影響(本研究成果の意義)
本研究成果により、ラミニンα5鎖遺伝子のヘテロ変異を原因とするヒトの腎疾患が存在したこと、FSGSの疾患メカニズムに細胞接着の異常が関与すること、ビンキュリン蛋白が本疾患のバイオマーカーとして診断に応用できる可能性が示唆され、新たな家族性腎疾患の診断及び治療法の開発が期待されます。
特記事項
本研究成果は、2022年9月29日(木)(日本時間)に米国科学誌「JCI Insight」(オンライン)に掲載されました。
タイトル:“A heterozygous LAMA5 variant may contribute to slowly progressive, vinculin-enhanced familial FSGS and pulmonary defects”
著者名:貝森淳哉1,2*, 吉川大和3*, 元岡大輔4, 難波倫子2, 多久和綾子5, 岡崎敦子6, 小林香織7, 谷川亜里紗8, 小谷祐子8, 夘野善弘8, 吉見一人9, 服部洸輝2, 朝比奈悠太2, 梶本幸男2, 土井洋平2, 岡 樹史2, 坂口悠介1,2, 真下知二9, 関口清俊10, 中谷明弘11, 野水基義3, 猪阪善隆2(*責任著者)
所属:
1. 大阪大学 大学院医学系研究科 腎疾患臓器連関制御学
2. 大阪大学 大学院医学系研究科 腎臓内科学
3. 東京薬科大学 薬学部 病態生化学
4. 大阪大学微生物病研究所 遺伝情報実験センター
5. 大阪大学免疫学フロンティア研究センター
6. 順天堂大学 大学院医学系研究科 難治性疾患診断・治療学
7. 大阪大学 大学院医学系研究科 ゲノム情報学
8. 大阪大学医学部附属動物実験施設
9. 東京大学 医科学研究所 実験動物研究施設 先進動物ゲノム研究分野
10. 大阪大学蛋白質研究所 マトリクソーム科学研究部門
11. 東京大学 大学院新領域創成科学研究科メディカル情報生命専攻
DOI:https://doi.org/10.1172/jci.insight.158378
本研究は、『超高速DNAシーケンサーを用いた疾患原因ゲノム領域の同定と情報解析法の確立、および参照配列データの作成に関する研究』研究の一環として行われ、大阪大学 大学院医学系研究科 医の倫理と公共政策学 加藤和人教授の協力を得て行われました。
用語説明
- ラミニンα5鎖
細胞外の基質(マトリックス)の主な構成蛋白のラミニンは、異なる種類の3種類のα鎖、β鎖、γ鎖蛋白からなり、ラミニンα5鎖は、α鎖のうちのひとつ。
- ヘテロ遺伝子変異
対立遺伝子の片方に変異がある場合に、ヘテロ遺伝子変異と呼ばれる。
- 家族性巣状分節性糸球体硬化症
巣状分節性糸球体硬化症(FSGS)は、尿に蛋白が漏れる組織病変の名前で、それが遺伝する疾患が、家族性巣状分節性糸球体硬化症。
- ビンキュリン
細胞が基質に接着する部位に発現する、力(ちから)のセンサーの役割を担っている分子。
- 全エクソームシークエンス解析
次世代シークエンサーを用いて、ゲノムDNA上に存在する遺伝子のexonを網羅的に解析する手法。
