腎疾患に関わる細胞「ポドサイト」を 保護するメカニズムを解明
タンパク質GIT2を標的とした治療法開発に期待
研究成果のポイント
- 腎臓の細胞「ポドサイト」における、細胞保護メカニズムを解明。
- 尿蛋白を生じる腎疾患では、Rac1というタンパク質がポドサイトにおいて活発になっていることが知られていたが、そのメカニズムは不明だった。
- GIT2と呼ばれる分子が、Rac1というタンパク質を抑制してポドサイトの形態・機能を維持することを解明。
- GIT2-Rac1経路を腎疾患治療の標的とすることで、ポドサイトを保護して腎疾患の進行を防ぐ新しい治療法の開発が期待される。
概要
大阪大学大学院医学系研究科腎臓内科学の松田潤特任助教(常勤)、大学院生の島田直幸さん(博士後期課程)、猪阪善隆教授らの研究グループは、腎臓の中で働く特別な細胞の一つである「ポドサイト」について、新しい細胞保護メカニズムを解明しました。
ポドサイトは腎臓の糸球体の構成細胞の1つで、細かな足突起構造が張りめぐらされていることから「たこ足細胞」とも呼ばれています。これまでネフローゼ症候群や高血圧性腎症など、尿蛋白を生じる多くの腎疾患において、蛋白群Rho GTPaseの1つであるRac1という分子がポドサイトで活発になっていることが知られていました。一方で、ポドサイトのRac1活性がどのように調節されているかについては未解明でした。
今回研究グループは、マウスと培養ポドサイトを用いて、GIT2という分子がRac1の活性を抑制してポドサイトを傷害から守ることを解明しました。また、その分子メカニズムとして、GIT2が脱リン酸化酵素PTP1Bの接着斑への移行を助け、p130Cas蛋白のリン酸化を抑制することを解明しました(図1)。
ポドサイトは基本的に再生能を持たないため、ポドサイトが不可逆的な傷害を受けると腎機能の改善は難しくなり、最終的に透析療法や移植に頼らざるを得なくなります。本研究成果を活かし、今後GIT2がポドサイトのRac1経路における新規治療標的となることが期待されます。
本研究成果は、米国科学誌「Journal of the American Society of Nephrology」に、2月28日(金)(日本時間)に公開されました。
図1. 研究概略
ポドサイトのGIT2は脱リン酸化酵素PTP1Bの接着斑への移行を促進し、p130Casのリン酸化を抑制することで、Rac1の活性化を防いでいる。
研究の背景
ポドサイトはアクチン線維を骨格とする細かな足突起構造を張り巡らしており、「たこ足細胞」とも呼ばれています。足突起は、ポドサイトが基底膜に接着する上で重要であると同時に、隣り合うポドサイト同士が足突起を組み合わせることで、蛋白の尿への漏出を防いでいます(図2)。
図2. 糸球体毛細血管の断面図。ポドサイトは足突起を伸ばし、糸球体内皮細胞および基底膜とともに濾過バリアを形成する。このバリア機構により血清蛋白の尿への漏出を防いでいる。ポドサイトは接着斑を介して糸球体基底膜に接着している。
このアクチン線維の調節に関わっているのが、Rho GTPaseと呼ばれる蛋白群です。その1つであるRac1がポドサイトで活性化すると、足突起の形態が変化して尿蛋白を生じることや、ポドサイトが基底膜から脱落し糸球体硬化に至ることが知られています。また実際に、尿蛋白を生じる病気(ネフローゼ症候群や高血圧性腎症など)でポドサイトのRac1が活性化していることが、ヒトの腎生検検体や動物モデルで報告されています。
研究の内容
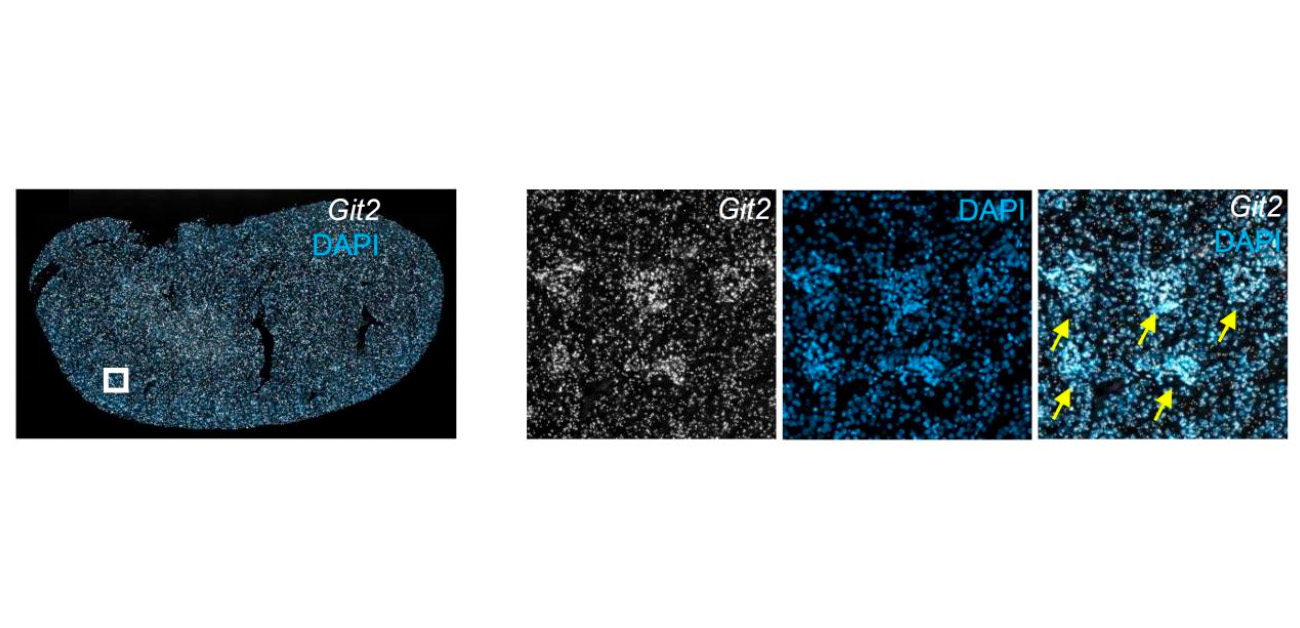
研究グループは、Rac1を抑制してポドサイトを保護するメカニズムを解明するため、近位依存性ビオチン標識という手法によって同定したRac1関連蛋白の1つ、GIT2に着目しました。まずGIT2の腎臓における発現分布を調べたところ、尿細管や間質に比べて糸球体で発現量が多いことが分かりました(図3)。
図3. マウス腎臓におけるGIT2の分布。右図は左図□内の拡大写真。腎臓の他の部位に比べて糸球体(➡)でGIT2(白)の発現量が多い。DAPIによる青染部は細胞の核を表す。
次に、ポドサイト特異的GIT2欠損(ノックアウト)マウスを樹立し、表現型を解析しました。複数のポドサイト傷害モデルにおいて、ノックアウトマウスでは対照マウスと比較して、ポドサイトの足突起形態が悪化し、尿蛋白も増加しました(図4)。ノックアウトマウスにRac1阻害薬を投与すると足突起の形態変化や尿蛋白が軽減したことから、GIT2がRac1活性を抑制することでポドサイトを傷害から保護していることが示唆されました。
図4. ポドサイト傷害モデルにおける足突起の電子顕微鏡写真。GIT2欠損マウスでは対照マウスに比べて細やかな足突起構造が失われる(➡)が、Rac1阻害薬投与マウスでは維持されている。
続いて、培養ポドサイトを用いてその分子メカニズムを解明しました。まずGIT2はポドサイトの接着斑に局在することが分かりました。そしてGIT2発現が低下した細胞ではRac1活性が亢進し、細胞形態の変化や運動能の亢進が見られました(図5)。
図5. 細胞のアクチン線維を表す染色写真。GIT2欠損ポドサイトでは細胞面積が増加し、Rac1活性亢進に特徴的な仮足形成が細胞辺縁で目立つ(➡)。白スケールは50µm。
同細胞では、脱リン酸化酵素であるPTP1Bの接着斑への移行が障害され(図6)、接着斑にRac1を引き寄せる蛋白であるp130Casのリン酸化が亢進していました。
これらの表現型は、細胞に再度GIT2を発現させることで改善したことから、GIT2はPTP1Bの接着斑への移行を助け、p130Cas蛋白のリン酸化を抑制することで、Rac1活性を抑えることが明らかとなりました。
図6. PTP1B(緑)と接着斑構成蛋白パキシリン(赤)の細胞内動態を見たライブセルイメージング。対照細胞では細胞運動とともにPTP1Bが細胞前縁部の接着斑へ移行するのに対し、GIT2欠損細胞ではPTP1Bの接着斑への移行が障害されている(➡)。
本研究成果が社会に与える影響(本研究成果の意義)
高齢化が進む中、高血圧やネフローゼ症候群から慢性腎臓病(CKD)をきたす人が増えています。CKDに対する薬物療法はいくつかありますが、ポドサイトは基本的に再生能を持たないため、ポドサイトが不可逆的な傷害を受けると腎機能の改善は難しくなり、最終的に透析療法や移植に頼らざるを得なくなります。本研究により明らかとなったRac1を抑制するメカニズムは、ポドサイトを保護して腎機能を維持する上で重要と考えられます。
特記事項
本研究成果は、2025年2月28日(金)(日本時間)に米国科学誌「Journal of the American Society of Nephrology」(オンライン)に掲載されました。
タイトル:“Rac1 suppression by the focal adhesion protein GIT ArfGAP2 and podocyte protection”
著者名:Naoyuki Shimada1, Jun Matsuda1*, Kana Asano-Matsuda1, Maho Tokuchi1, Lamine Aoudjit2, Agnieszka Masztalerz2, Serge Lemay2, Tomoko Takano2, Yoshitaka Isaka1 (*責任著者)
所属:
1. 大阪大学 大学院医学系研究科 腎臓内科学
2. McGill大学 ヘルスセンター 腎臓内科学
DOI:https://doi.org/10.1681/asn.0000000614
本研究はカナダ・McGill大学腎臓内科 高野朋子教授の研究グループの協力を得て行われました。
参考URL
松田 潤 特任助教(常勤)研究者総覧
https://rd.iai.osaka-u.ac.jp/ja/d7d72d4e4030d93b.html
猪阪 善隆 教授 研究者総覧
https://rd.iai.osaka-u.ac.jp/ja/e6f37e55995dcccf.html
用語説明
- 糸球体
血液を濾過して尿を生成する球状の構造体。血液側から順に糸球体内皮細胞・基底膜・ポドサイトの三層で濾過バリアを形成し、尿中に蛋白や血球が漏れ出るのを防いでいる。
- ネフローゼ症候群
著明な尿蛋白と、それに伴う低蛋白血症、全身の浮腫を引き起こす疾患の総称。その原因は多様だが、主にポドサイトの足突起形態が変化して糸球体濾過バリアが破綻することにより発症する。
- Rho GTPase
GDP結合型(不活化型)とGTP結合型(活性型)の2形態をとるスイッチ蛋白。活性型Rho GTPaseは、細胞骨格を形成するアクチン線維の構造を変化させ、細胞の形態・接着・運動能に関わる。
- 接着斑
細胞と細胞外基質をつなぐ分子複合体。ポドサイトの接着斑では、接着分子であるインテグリンが細胞の外側で基底膜と、内側でアクチン線維と結合し、内外のシグナル伝達が行われている。
- 糸球体硬化
糸球体傷害により、糸球体構造が破壊されて硬化した状態。不可逆的に濾過機能が失われる。
