潰瘍性大腸炎の発症・重症化のメカニズムを解明
OTUD3は腸内細菌が誘導する炎症応答を制御する
研究成果のポイント
- 脱ユビキチン化酵素OTUD3が腸内細菌叢の乱れによる潰瘍性大腸炎(UC)の発症や悪化を防ぐために必須の分子であることを発見
- 世界的に患者数が増加しているUCについて、発症や重症化の詳細なメカニズムは解明されていないが、今回、特定の遺伝子変異と腸内環境の異常が線維芽細胞を介して結びつくことでUCの発症や重症化の原因となることが明らかに
- 遺伝子変異情報を基にしたUCの個別治療法の開発に期待
概要
大阪大学 高等共創研究院の香山尚子准教授(免疫学フロンティア研究センター兼任)、大学院医学系研究科の竹田潔教授(免疫学フロンティア研究センター兼任)らのグループは、脱ユビキチン化酵素 OTUD3が腸内細菌叢の乱れによるUCの発症や悪化を防ぐために必須の分子であることを明らかにしました。
UCは指定難病のひとつであり、世界的に患者数が増加していますが、発症や重症化にかかわる詳細なメカニズムは完全に解明されていません。その中でもOTUD3遺伝子変異とUCリスクの関係が報告されていましたが、どのように発症/重症化に寄与するかは不明でした。
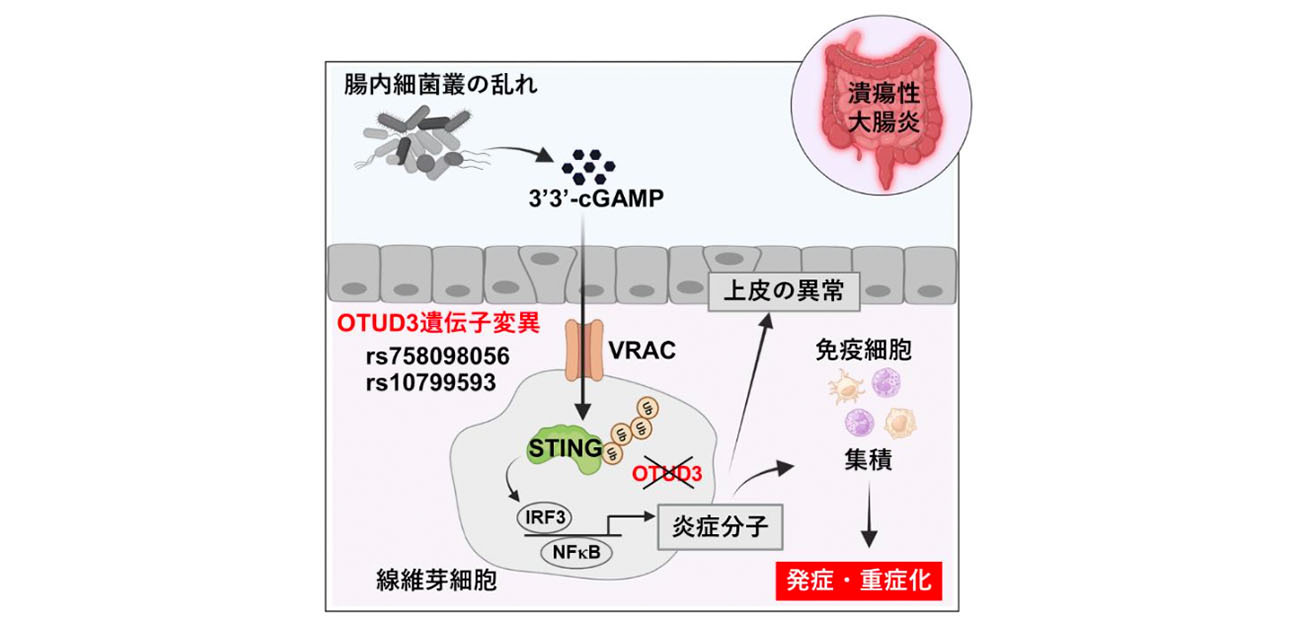
今回、研究グループがUC患者さんの腸から採取した細胞を用いて解析を行ったところ、OTUD3タンパク質が線維芽細胞に発現する分子であること、OTUD3遺伝子に、UCリスクとなる一塩基多型(SNP)をもつ患者さんの線維芽細胞ではOTUD3のタンパク質発現量が低下していることがわかりました。また、線維芽細胞に発現するOTUD3は、腸内細菌が分泌する分子3’3’-cGAMPが誘導するSTING炎症シグナルを抑制することを見いだしました。さらに、Otud3遺伝子にUCリスクSNPをもつマウスに、3’3’-cGAMP産生細菌が多く含まれるUC患者さんの腸内細菌叢を移植するとUCに似た症状を引き起こすことを明らかにしました。以上のことから、OTUD3遺伝子に変異をもつUC患者さんでは、腸内細菌が分泌する3’3’-cGAMPに対する過剰な炎症応答が疾患の発症や重症化につながっていることが明らかになりました(図)。本研究の成果より、3’3’-cGAMPを産生する腸内細菌やSTINGシグナルが潰瘍性大腸炎の治療規標的となる可能性が期待されます。
本研究成果は、米科学誌「Science Immunology」に7月19日(土)午前3時(日本時間)に公開されました。
研究の背景
潰瘍性大腸炎は指定難病のひとつであり、世界的に患者数が増加しています。これまでの解析から「遺伝子の変異」「腸内微生物叢の変化」「免疫応答の異常」が病態にかかわっているとされていますが、発症や重症化にかかわる詳細なメカニズムについては完全には解明されていません。OTUD3遺伝子には潰瘍性大腸炎リスクSNPが存在することが報告されていましたが、なぜOTUD3遺伝子に変異があると潰瘍性大腸炎の発症/重症化リスクが高くなるのか、そのメカニズムは不明です。
研究の内容
研究グループは、マウスとヒト正常大腸組織から採取した細胞を用いてOTUD3タンパク質の発現を調べたところ、免疫細胞や上皮細胞にOTUD3は発現しておらず線維芽細胞に強く発現することが明らかになりました。
次に、線維芽細胞でのみOtud3遺伝子がないマウスを作成し、潰瘍性大腸炎に似た腸炎を発症させるためにデキストラン硫酸塩(DSS)を経口投与したところ、大腸炎が重症化することがわかりました。また、Otud3遺伝子がない大腸線維芽細胞では、腸内細菌が産生する分子3’3’-cGAMPによるSTINGシグナルの活性化が亢進することを見いだしました。
そこで、Otud3遺伝子とSting遺伝子の両方をもたないマウスを作成し、DSSを経口投与したところ、大腸炎の重症化は起こりませんでした。さらに、Otud3遺伝子に潰瘍性大腸炎の発症リスクSNP(rs758098056)をもつマウス(Otud3 R89Qマウス)を作成し、DSSを経口投与したところ大腸炎が重症化しました。しかし、3’3’-cGAMPを細胞内に取り込むための輸送体VRACに対する阻害剤をOtud3 R89Qマウスに投与すると大腸炎は重症化しませんでした。
OTUD3遺伝子にSNP(rs10799593)をもつヒト大腸線維芽細胞では、OTUD3タンパク質の発現が低下していること、3’3’-cGAMPによるSTINGシグナル活性化が亢進することがわかりました。
腸内細菌叢解析の結果、健常者にくらべ潰瘍性大腸炎の患者さんでは、3’3’-cGAMPを産生する腸内細菌が増加していること、それに伴い、腸内の3’3’-cGAMP濃度が上昇していることが明らかになりました。
Otud3 R89Qマウスと野生型マウスに健常者の腸内細菌叢もしくは潰瘍性大腸炎患の細菌叢(3‘3’-cGAMP産生細菌を多く含む細菌叢)を移植しました。その結果、潰瘍性大腸炎型腸内細菌叢をもつOtud3 R89Qマウスにのみ潰瘍性大腸炎様の症状があらわれました。しかし、Sting遺伝子を欠損させたOtud3 R89Qマウスに潰瘍性大腸炎型腸内細菌叢を移植しても症状はあらわれませんでした。
以上のことから、OTUD3遺伝子に変異をもつ潰瘍性大腸炎患者さんでは、腸内細菌の乱れにより3’3’-cGAMPが増加すると線維芽細胞においてSTING炎症シグナルが亢進し疾患の発症や重症化の原因となることが明らかになりました。
本研究成果が社会に与える影響(本研究成果の意義)
本研究では、特定の遺伝子変異(OTUD3遺伝子の変異)と腸内環境の異常(腸内細菌叢の乱れによる3’3’-cGAMPの増加)が線維芽細胞を介して結びつくことで潰瘍性大腸炎の発症や重症化の原因となることを明らかにしました。本研究で得られた知見から、3’3’-cGAMP産生細菌、cGAMP輸送体VRAC、STINGシグナル経路を標的とした潰瘍性大腸炎の個別化療法の開発が期待されます。
特記事項
掲載紙:Science Immunology 2025年7月19日(土)午前3時(日本時間)解禁
タイトル:OTUD3 prevents ulcerative colitis by inhibiting microbiota-mediated STING activation
著者名:Bo Li1,2#, Taiki Sakaguchi1#, Haruka Tani1,3#, Takayoshi Ito1, Mari Murakami1,3, Ryu Okumura1,3,4, Masao Kobayashi1, Daisuke Okuzaki3,4,5,6, Daisuke Motooka3,4,5,7, Hiroki Ikeuchi8, Takayuki Ogino9, Tsunekazu Mizushima9,10, Seiichi Hirota11, Yuriko Otake-Kasamoto12, Toshihiro Kishikawa13,14, Shota Nakamura3,4,5,7, Kouji Kobiyama15, Ken J Ishii3,15, Takao Hashiguchi16, Taro Kawai17, Etsushi Kuroda18, Shinichiro Shinzaki12,19, Wataru Ise3,6, Tomohiro Kurosaki3, Akira Kikuchi6, Yoshihiko Tomofuji13,20,21,22,23,24, Yukinori Okada3,5,13,20,21,25, Kiyoshi Takeda1,3,4,6*, and Hisako Kayama1,3,26* #)同等貢献 *)責任著者
所属
- Laboratory of Immune Regulation, Department of Microbiology and Immunology, Graduate School of Medicine, The University of Osaka, Suita, Osaka 565-0871, Japan.
- Department of Gastroenterology, Endoscopy Center, Shanghai East Hospital, School of Medicine, Tongji University, Shanghai, 200136, China
- WPI Immunology Frontier Research Center, The University of Osaka, Suita, Osaka 565-0871, Japan.
- Integrated Frontier Research for Medical Science Division, Institute for Open and Transdisciplinary Research Initiatives, The University of Osaka, Suita 565-0871, Japan.
- Genome Information Research Center, Research Institute for Microbial Diseases, The University of Osaka, Suita, Osaka 565-0871, Japan.
- Center for Infectious Disease Education and Research, The University of Osaka, Suita, Osaka 565-0871, Japan.
- Department of Infection Metagenomics, Research Institute for Microbial Diseases, The University of Osaka, Suita, Osaka 565-0871, Japan.
- Department of Gastroenterological Surgery, Division of Inflammatory Bowel Disease Surgery, Hyogo Medical University, Nishinomiya, Hyogo 663-8501, Japan.
- Department of Gastroenterological Surgery, Graduate School of Medicine, The University of Osaka, Suita, Osaka 565-0871, Japan.
- Department of Gastroenterological Surgery, Osaka Police Hospital, Osaka, Osaka 543-0035, Japan.
- Department of Surgical Pathology, Hyogo Medical University, Nishinomiya, Hyogo 663-8501, Japan.
- Department of Gastroenterology and Hepatology, Graduate School of Medicine, The University of Osaka, Suita, Osaka 565-0871, Japan.
- Department of Statistical Genetics, Graduate School of Medicine, The University of Osaka, Suita, Osaka 565-0871, Japan.
- Department of Head and Neck Surgery, Aichi Cancer Center Hospital, Nagoya, Aichi 464-8681, Japan
- Division of Vaccine Science, Department of Microbiology and Immunology, The Institute of Medical Science, The University of Tokyo (IMSUT), Tokyo 108-8639, Japan.
- Institute for Life and Medical Sciences, Kyoto University, Kyoto, Kyoto 606-8507, Japan
- Laboratory of Molecular Immunobiology, Division of Biological Science, Graduate School of Science and Technology, Nara Institute of Science and Technology (NAIST), Ikoma, Nara 630-0192, Japan.
- Department of Immunology, School of Medicine, Hyogo Medical University, Nishinomiya, Hyogo 663-8501, Japan.
- Department of Gastroenterology, Hyogo Medical University, Nishinomiya, Hyogo 663-8501, Japan.
- Department of Genome Informatics, Graduate School of Medicine, the University of Tokyo, Tokyo 113-0033, Japan.
- Laboratory for Systems Genetics, RIKEN Center for Integrative Medical Sciences, Kanagawa 230-0045, Japan.
- Center for Data Sciences, Brigham and Women’s Hospital, Boston, MA, 02115, USA
- Divisions of Genetics and Rheumatology, Department of Medicine, Brigham and Women’s Hospital, Harvard Medical School, Boston, MA, 02115, USA
- Program in Medical and Population Genetics, Broad Institute of MIT and Harvard, Cambridge, MA, 02142, USA
- Premium Research Institute for Human Metaverse Medicine (WPI-PRIMe), The University of Osaka, Suita 565-0871, Japan
- Institute for Advanced Co-Creation Studies, The University of Osaka, Suita, Osaka 565-0871, Japan
DOI: 10.1126/sciimmunol.adm6843
本研究は、日本学術振興会(JSPS)、科学技術振興機構(JST)、木下記念事業団、大阪大学女性研究者支援事業、日本医療研究開発機構新的先端研究開発 支援事業CREST「腸内微生物叢の宿主共生と宿主相互作用機 構の解明」、日本医療研究開発機構革新的先端研究開発 支援事業PRIME「間葉系ストローマ細胞と免疫細胞の相互作用による腸管恒常性維持機構に関する研究開発」より支援を受けて実施されました。
用語説明
- 脱ユビキチン化酵素
たんぱく質に結合したユビキチを取り除く働きを持つ酵素である。76個のアミノ酸からなるユビキチンは標的タンパク質に結合する(タンパク質をユビキチンする)ことで、プロテオソームによる選択的分解やシグナル伝達など様々な生命活動の制御にかかわっている。
- 潰瘍性大腸炎(UC)
厚生労働省により難病に指定されている疾患。大腸に炎症と潰瘍が生じる疾患であり発症原因は解明されていない。上皮バリアの異常や腸内細菌に対する免疫応答が制御できないことが病態に関与すると考えられている。
- 線維芽細胞
体の中のさまざまな組織に存在する非血球系の細胞でPDGFRaやPodoplaninといった分子を発現している。正常な組織形態の維持や傷ついた組織の修復をする細胞。潰瘍性大腸炎患者さんの大腸線維芽細胞では炎症関連分子の発現が高くなっていることが報告されている。
- 一塩基多型 (SNP)
Single Nucleotide Polymorphism、ゲノムDNAの塩基配列の特定位置において一つの塩基が別の塩基に置き換わる遺伝的変異。病気のかかりやすさや薬の効きやすさといった個人差を生む主要な原因の一つである。
- 3’3’-cGAMP
ウイルスが感染した細菌においてcGASにより産生されるセカンドメッセンジャー環状核酸。宿主細胞に取り込まれるとSTINGを活性化してI型IFN (IFN-やIFN-)の発現を誘導する。
- STING
細胞内核酸センサーの1つ。細菌が産生する3’3’-cGAMPや宿主細胞が産生する2’3’-cGAMPを認識し活性化すると、リン酸化酵素TBK1による転写因子IRF3のリン酸化を介してⅠ型IFNの発現を惹起することで細菌やウイルスに対する炎症応答を促進する。
