SGLT2阻害薬による腎保護作用の新メカニズムを解明
オートファジー障害を生じる多くの腎疾患への効果に期待
研究成果のポイント
- SGLT2阻害薬の中でもエンパグリフロジンと呼ばれる薬剤について、非糖尿病患者において腎保護効果を発揮するメカニズムの一部を解明。
- 近年、糖尿病治療薬として知られるSGLT2阻害薬の腎保護効果が明らかになり、様々な機序が提唱されているが、確定的なものはまだなく、オートファジーに着目した機序は十分に検討されていない。
- SGLT2阻害薬(エンパグリフロジン)は、糸球体過剰濾過を改善することで、尿細管へのアルブミン曝露量を減少させ、オートファジー障害を改善することが明らかになった。また、急性腎障害(AKI)を軽減することが確認された。
- 慢性腎臓病患者において、腎機能低下・透析導入への進行を抑制する治療薬として幅広く活用されることに期待。
概要
大阪大学医学部附属病院血液浄化部の松井 翔医員(研究当時大阪大学大学院医学系研究科の博士後期課程)、大学院医学系研究科 山本 毅士 特任助教(常勤)、 猪阪 善隆 教授(腎臓内科学)らの研究グループは、SGLT2阻害薬の腎保護作用に関する新しいメカニズムを明らかにしました。
近年、糖尿病治療薬であるSGLT2阻害薬の腎保護効果が明らかになり様々な機序が提唱されていますが、確定的なものはまだなく、またオートファジーに着目した機序も十分には検証されていませんでした。さらに最近の研究で、SGLT2阻害薬は尿蛋白の少ない非糖尿病患者さんでも腎保護効果が期待できることが示唆されていましたが、その詳細なメカニズムは解明されていませんでした。
今回、研究グループは、SGLT2阻害薬の中でもエンパグリフロジン(エンパグリフロジン、以下EMPA)と呼ばれる薬剤を用いた実験を行い、尿蛋白の少ないマウスモデル(肥満モデル・5/6腎摘モデル)においてEMPAが糸球体過剰濾過を改善することで尿細管へのアルブミン曝露を軽減し、オートファジー障害を改善することを明らかにしました。さらに、虚血再灌流モデルによるマウス実験では、EMPAはオートファジーを改善し、急性腎障害(AKI)を軽減させることも明らかとしました。これらの結果により、尿蛋白の少ない非糖尿病患者さんにおいても、EMPAが幅広く腎保護効果を発揮する機序の一端が明らかとなりました(図1)。
本研究成果は、2024年10月14日(月)に米国科学誌「Autophagy」(オンライン)に掲載されました。
図1. 研究概略
糸球体過剰濾過により尿細管へのアルブミン曝露が増加すると、オートファジー障害が生じる。SGLT2阻害薬(エンパグリフロジン)は、糸球体内圧低下と全身代謝改善により、尿中アルブミンの質と量を改善しオートファジー障害を改善する。その結果、CKD進展やAKI発症の抑制効果が期待される。
研究の背景
近年、糖尿病治療薬であるSGLT2阻害薬は、糖尿病だけでなく、非糖尿病の慢性腎臓病(CKD)進展を抑制することが明らかになっています。また、大規模なメタ解析から急性腎障害(AKI)の発症を抑制する効果も示され、腎臓病治療において大きな注目を集めています。しかし、その腎保護効果のメカニズムは、糸球体過剰濾過改善をはじめとして様々な説が唱えられているものの、確定的なものではありません。また、オートファジーに着目した機序も十分に解明されていません。最近の研究では、尿蛋白の少ない非糖尿病患者さんにおいてもSGLT2阻害薬の腎保護効果が示唆されていますが、現在まで提唱されてきた機序では幅広い腎保護効果の理由は説明できませんでした。
研究の内容
研究グループは、近位尿細管におけるメガリンを介したアルブミン再吸収とオートファジーリソソーム系に着目し、EMPAの腎保護作用の機序を検討しました。
高脂肪食2か月モデル(肥満モデル)は、糸球体内圧が上昇する一方で尿蛋白が少ないモデルです。野生型マウスに対して通常食、高脂肪食、高脂肪食+EMPAの負荷を行い、腎臓を評価しました。高脂肪食では空胞病変が形成されましたが、EMPA投与により改善しました(図2)。この空胞はリソソームマーカーであるLAMP1陽性でトルイジンブルー陽性であることからリソソーム内リン脂質であることがわかり、高脂肪食肥満によるリソソーム負担は、EMPA投与により軽減していることが分かりました。
図2. 肥満モデルで増加したリソソーム内リン脂質蓄積はEMPA投与により軽減する
野生型マウスに対して通常食、高脂肪食、高脂肪食+EMPA負荷を行い、PAS染色、免疫染色(茶色:LAMP1、青:メガリン)、トルイジンブルー染色を行った。PAS染色から高脂肪食で形成された空胞病変はEMPA投与で改善した。この空胞病変はリソソームマーカーであるLAMP1陽性でトルイジンブルー陽性であることからリソソーム内リン脂質であった。
次に、SGLT2阻害薬は糸球体内圧を下げることが広く知られているため、メガリンを介したアルブミン再吸収量(尿細管への曝露量)がEMPA投与によってどのように変化するかを評価しました。タモキシフェン誘導性近位尿細管特異的メガリンノックアウトマウスを作成し、肥満モデルマウスで尿中アルブミンを検証したところ、肥満モデルマウスでアルブミン再吸収量は増加しましたが、EMPA投与により軽減していることが分かりました(図3)。
図3. 高脂肪食負荷で増加したアルブミン再吸収量はEMPA投与により軽減する
タモキシフェン誘導性近位尿細管特異的メガリンノックアウトマウスを使用した。タモキシフェン投与によりメガリンがノックアウトされると、メガリンを介して再吸収されるアルブミンが尿中に排泄されるため、タモキシフェン投与前後の尿アルブミン値の差をアルブミン再吸収量と定義した。肥満モデルマウスではアルブミン再吸収量が増加し、EMPA投与により軽減した。
次に、尿細管へのアルブミン曝露が減ったことで、オートファジーがどのように変化するかを評価するために、オートファゴソームをGFP陽性ドットとして可視化できるGFP-LC3トランスジェニックマウスを使用しました。正確にオートファジー活性を評価するためにオートファジーを阻害するクロロキンを投与し、肥満マウスの摂食下と24時間絶食下でのGFP-LC3ドットの評価を行いました。肥満マウスではオートファジー障害を認めましたが、EMPA投与によりオートファジー障害は改善しました。
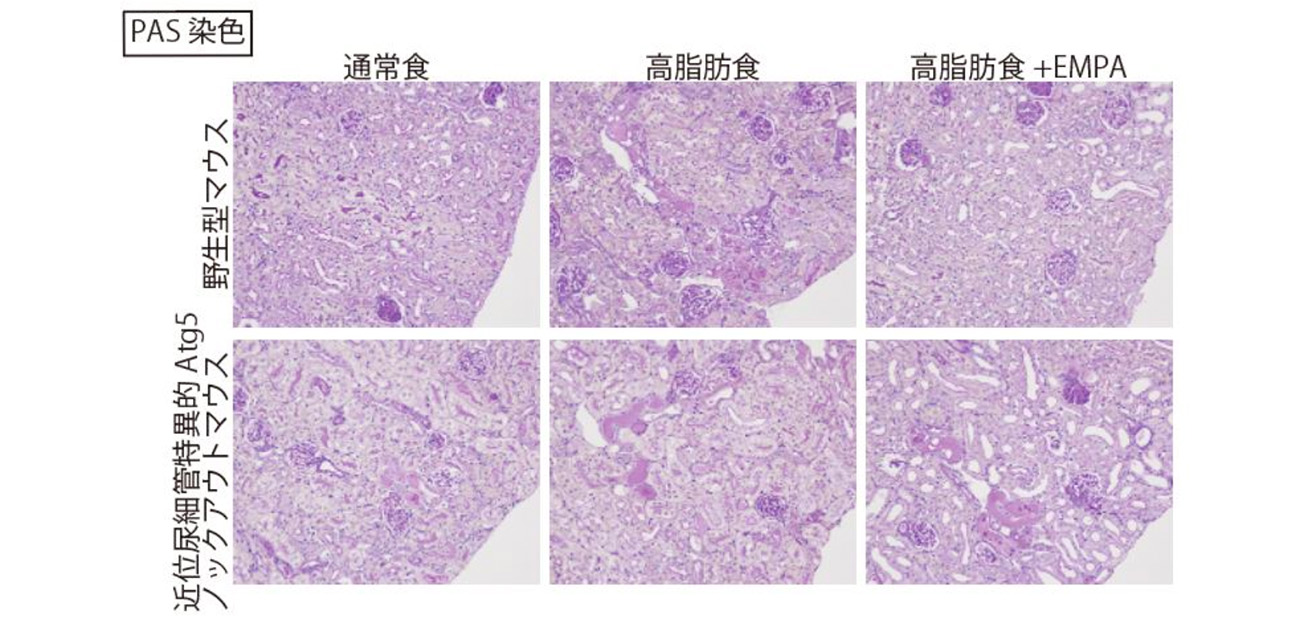
最後に、EMPAはオートファジー障害を改善させることで急性腎障害(AKI)に対して腎保護効果を発揮するかどうかを検証するために、タモキシフェン誘導性近位尿細管特異的Atg5ノックアウトマウスを使用し、虚血再灌流傷害によるAKIモデルにおいて評価しました。野生型の肥満マウスで虚血再灌流傷害による腎障害悪化を認めましたが、EMPA投与により腎障害は改善しました。一方、オートファジー不全マウスではEMPAによる腎保護効果は認められませんでした(図4)。これにより、EMPAはオートファジー依存的に腎保護効果を発揮することが示されました。
図4. EMPAはオートファジー依存的に虚血再灌流障害を改善させる
野生型マウス・近位尿細管特異的Atg5ノックアウトマウスに対して通常食・高脂肪食・高脂肪食+EMPA負荷を行い、腎臓に虚血再灌流傷害を行って2日後のPAS染色を示す。野生型マウスではEMPA投与により高脂肪食による腎障害の悪化が改善するが、近位尿細管特異的Atg5ノックアウトマウスではEMPAの腎保護効果が消失した。
本研究成果が社会に与える影響(本研究成果の意義)
薬剤を用いたオートファジー活性の調整は様々な疾患で試みられていますが、単純にオートファジー活性を上昇させるだけではリソソームの機能に負担がかかるだけとなり、効果が得られない疾患が多数存在します。本研究では、EMPAが単にオートファジーを亢進させるのではなく、リソソーム負担を解除し、オートファジー障害を改善させることで腎保護効果を発揮することが明らかとなりました。肥満や糖尿病だけでなく、加齢に伴う腎老化においてもオートファジー障害は生じています。今後、EMPAが幅広いCKD患者さんにおいて、腎機能低下・透析導入への進行を抑制する治療薬として活用されることが期待されます。
特記事項
本研究成果は、2024年10月14日(月)に米国科学誌「Autophagy」(オンライン)に掲載されました。
タイトル:“Empagliflozin Protects the Kidney by Reducing Toxic Albumin Exposure and Preventing Autophagic Stagnation in Proximal Tubules”
著者名:Sho Matsui1, Takeshi Yamamoto1,*, Yoshitsugu Takabatake1, Atsushi Takahashi1, Tomoko Namba-Hamano1, Jun Matsuda1, Satoshi Minami1, Shinsuke Sakai1, Hiroaki Yonishi1, Jun Nakamura1, Shihomi Maeda1, Ayumi Matsumoto1, Isao Matsui1, Motoko Yanagita2,3, and Yoshitaka Isaka1
所属:
1. 大阪大学 大学院医学系研究科 腎臓内科学
2. 京都大学 大学院医学研究科 腎臓内科学
3. 京都大学 高等研究院ヒト生物学高等研究拠点(ASHBi)
DOI:10.1080/15548627.2024.2410621
参考URL
山本 毅士 特任助教(常勤)研究者総覧
https://rd.iai.osaka-u.ac.jp/ja/44d6ff1f0b8a80e4.html?k=%E5%B1%B1%E6%9C%AC
用語説明
- SGLT2阻害薬
SGLT2は腎臓の糸球体で濾過された糖を近位尿細管で再吸収するトランスポーターである。SGLT2阻害薬は尿中への糖排泄を促すことで血糖降下作用を有する糖尿病治療薬であるが、近年糖尿病だけでなく、非糖尿病においても腎保護効果を有することが大規模臨床試験で判明した。SGLT2阻害薬は数種類あり、今回はエンパグリフロジンを実験に用いた。
- オートファジー
細胞構成成分を分解し、エネルギーの再利用や細胞内小器官の修復に携わる。分解基質がオートファゴソームという二重膜小胞に隔離され、分解酵素に富むリソソームに融合することで分解が生じる。
- 虚血再灌流モデル
腎動脈・腎静脈を一定時間遮断したのち、血流を再開することで腎傷害を引き起こす実験手法。
- 近位尿細管
腎臓は主に糸球体と尿細管から構成される。糸球体でろ過された血液は原尿となり、近位尿細管・遠位尿細管・集合管からなる尿細管で水分や電解質、栄養素などの再吸収が行われ、尿として体外に排泄される。なかでも近位尿細管は糖やアミノ酸、アルブミンなどの再吸収を担っており、エネルギー代謝が盛んで、また虚血再灌流傷害などのストレスにさらされやすいことから、オートファジーが重要な役割を果たす。
- メガリン
近位尿細管に発現するエンドサイトーシス受容体。腎臓の糸球体で濾過されたアルブミンは、主にメガリンを介したエンドサイトーシスにより再吸収されるため、健常人の尿中にはアルブミンはほぼ検出されない。近位尿細管特異的にメガリンをノックアウトすると尿中アルブミンが検出されるようになる。
