急性腎障害と慢性腎臓病の進展を阻むメカニズムを発見
慢性腎臓病患者や高齢者における腎不全進展の抑制に期待
研究成果のポイント
- 急性腎障害(AKI)は既に慢性腎臓病(CKD)がある患者や高齢者で起こりやすく、また他方、AKIを発症した患者ではCKDに移行しやすいことが知られているが、詳細なメカニズムはわかっていない。
- CKD患者の腎臓尿細管細胞において、老化細胞の増加とともに減少することが知られている転写因子MondoAの活性が低下していることがわかった。
- MondoAは虚血再灌流モデルによるマウス実験で、急性期にはオートファジー抑制因子Rubiconを抑制してAKIに対抗し、回復期にはTFEB-PGC1α経路を介したミトコンドリア生合成を維持してCKDへの進展を抑制することがわかった。
- Rubiconの阻害やTFEBの活性化によってMondoAが低下したCKD患者や高齢者においても腎臓病の進展を抑制できる可能性があり、治療法の開発が期待される。
概要
大阪大学大学院医学系研究科の大学院生の前田 志穂美さん(博士後期課程)、医学部附属病院 酒井 晋介 医員、大学院医学系研究科 山本 毅士 特任助教(常勤)、猪阪 善隆 教授(腎臓内科学)らの研究グループは、転写因子MondoAが急性腎障害(AKI)と慢性腎臓病(CKD)への進展に対抗する新しいメカニズムを明らかにしました。
これまでAKIは既にCKDと診断されている患者や高齢者で発症しやすく、AKIを発症した患者はCKDに移行しやすいことが知られていましたが、詳細なメカニズムは解明されていませんでした。
今回、研究グループは、転写因子MondoAの活性がCKD患者で低下していることを明らかにしました。また虚血再灌流モデルによるマウス実験で、急性期にMondoAがオートファジーを抑制する因子Rubiconを抑制することでオートファジー活性を維持し、AKIに対抗することを明らかにしました。さらに回復期にはMondoAが転写因子TFEBの活性を促進することでミトコンドリア生合成を維持し、CKDへの進展を抑制することも明らかとしました。これにより、Rubicon阻害やTFEBの活性化によってMondoAが低下したCKD患者や高齢者においても腎臓病の進展を抑制できる可能性があり、治療法の開発が期待されます。
本研究成果は、2024年5月31日(金)に米国科学誌「Journal of the American Society of Nephrology」(オンライン)に掲載されました。
図1. 研究概略
転写因子MondoAは急性期にはRubiconを抑制することでオートファジー活性を保ち、また回復期にはTFEB-PGC1α経路を活性化してミトコンドリア生合成を維持することにより、AKIやCKDへの進展を抑制する
研究の背景
これまで、急性腎障害(AKI)は既に慢性腎臓病(CKD)がある患者や高齢者で起こりやすく、またAKIを発症した患者ではCKDに移行しやすいことが知られていましたが、詳細なメカニズムはわかっていませんでした。本研究グループは以前、転写因子MondoAの活性が高齢者やAKI患者の腎臓尿細管細胞で低下すること、オートファジーを抑制する因子Rubiconを調節してオートファジーを促進すること、またMondoAがミトコンドリア機能を調整する転写因子TFEBとも関連があることを明らかにしました。オートファジーはAKIに対抗することも明らかにしており、ミトコンドリア機能を維持することがCKDへの進展を抑制することも知られています。
そこで転写因子MondoAがAKIの起こりやすさや、CKDへの移行に関わるのではないかと仮説を立て、ヒト腎生検検体や、虚血再灌流モデルによるマウス実験にて検証を行いました。
研究の内容
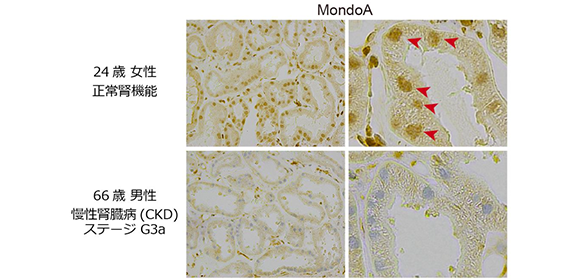
まず当院で腎生検を施行した患者さんの検体を用いて、MondoAの核への染色を調べたところ、腎機能が低下した患者(CKD患者)ではMondoAの染色が低下していることがわかりました(図2)。
図2. ヒト腎臓において慢性腎臓病(CKD)患者ではMondoAが低下する
正常腎機能の患者(上)とCKD患者(下)の腎臓。転写因子MondoAの核(青紫色)における染色性は、CKD患者では低下している。
次に転写因子MondoAがAKIおよびCKDへの移行に対し、どのように影響するかを明らかにするため、近位尿細管特異的MondoAノックアウトマウスを作製し、虚血再灌流モデルによるAKIと(2日後)、CKDへの移行(3週間後)の評価を行いました。
虚血再灌流から2日後の急性期にMondoAノックアウトマウスでは、腎組織傷害が著しく増悪していました(図3)。またMondoAノックアウトマウスではオートファジーを抑制する因子Rubiconの発現が増加し、オートファジーが抑制されていることを明らかにしました。MondoAとRubiconのダブルノックアウトマウスではオートファジーが改善し、腎組織傷害も改善していました。
CKDへの移行について、腎線維化の評価を虚血再灌流から3週間後に行うと、MonodAノックアウトマウスでは腎線維化が著明に増悪していることがわかりました(図4)。急性尿細管障害からの回復期にあたる虚血再灌流から1週間後の尿細管細胞では、野生型マウスでは転写因子TFEBが活性化していましたが、MondoAノックアウトマウスではこのTFEBの活性化がみられませんでした。MondoAノックアウトマウスではミトコンドリア生合成に重要な調節因子であるPGC1αの活性も低下していることがわかりました。TFEBを活性化することが知られているトレハロース(二糖類の一種)を投与すると、MondoAノックアウトマウスにおいても腎線維化が改善することを見出しました。
図3. MondoAのノックアウトは急性腎障害(AKI)を増悪させる
腎臓に虚血再灌流傷害を行って2日後の野生型マウス・近位尿細管特異的MondoAノックアウトマウスのPAS染色を示す。
MondoAのノックアウトにより腎組織の傷害の増悪がみられる。
図4. MondoAのノックアウトは慢性腎臓病(CKD)を増悪させる
腎臓に虚血再灌流傷害を行って3週間後の野生型マウス・近位尿細管特異的MondoAノックアウトマウスのコラーゲン1染色を示す。腎線維化は慢性腎臓病において典型的な組織像だが、MondoAのノックアウトによりコラーゲン1染色(茶色)で示される線維化の増悪がみられる。
本研究成果が社会に与える影響(本研究成果の意義)
慢性腎臓病(CKD)患者は世界的に増加しており、多くの国で社会問題となっています。急性腎障害およびCKDへの進展を抑制する治療の開発が求められています。本研究により、高齢者やCKD患者のようなMondoAが低下した病態でも、Rubicon阻害やTFEB活性化によって、腎不全進展を抑制する新しい治療が可能になると期待されます。
特記事項
本研究成果は、2024年5月31日(金)に米国科学誌「Journal of the American Society of Nephrology」(オンライン)に掲載されました。
タイトル:“MondoA and AKI and AKI-to-CKD transition”
著者名:Shihomi Maeda1, Shinsuke Sakai1, Yoshitsugu Takabatake1, Takeshi Yamamoto1,*, Satoshi Minami1, Jun Nakamura1, Tomoko Namba-Hamano1, Atsushi Takahashi1, Jun Matsuda1, Hiroaki Yonishi1, Sho Matsui1, Atsuhiro Imai1, Ryuya Edahiro2,3, Hitomi Yamamoto-Imoto4, Isao Matsui1, Seiji Takashima5, Ryoichi Imamura6, Norio Nonomura7, Motoko Yanagita8,9, Yukinori Okada2,10–13, Andrea Ballabio14–17, Shuhei Nakamura18, Tamotsu Yoshimori4,19,20, and Yoshitaka Isaka1
所属:
1. 大阪大学 大学院医学系研究科 腎臓内科学
2. 大阪大学 大学院医学系研究科 遺伝統計学
3. 大阪大学 大学院医学系研究科 呼吸器・免疫内科学
4. 大阪大学 大学院医学系研究科 遺伝学
5. 大阪大学 大学院医学系研究科 医化学
6. 長崎大学 大学院医歯薬学総合研究科 泌尿器科学
7. 大阪大学 大学院医学系研究科 泌尿器科学
8. 京都大学 大学院医学研究科 腎臓内科学
9. 京都大学 ヒト生物学高等研究拠点
10. 東京大学 大学院医学系研究科 遺伝情報学
11. 理化学研究所 生命医科学研究センター システム遺伝学
12. 大阪大学 免疫学フロンティア研究センター(iFReC) 免疫統計学
13. 大阪大学 ヒューマン・メタバース疾患研究拠点(PRIMe)
14. Telethon Institute of Genetics and Medicine (TIGEM), Pozzuoli, Naples, Italy.
15. Medical Genetics Unit, Department of Medical and Translational Science, Federico II University, Naples, Italy.
16. Department of Molecular and Human Genetics, Baylor College of Medicine, Houston, Texas, USA.
17. Jan and Dan Duncan Neurological Research Institute, Texas Children’s Hospital, Houston, Texas, USA.
18. 奈良県立医科大学 生化学講座
19. 大阪大学 大学院生命機能研究科(FBS) 細胞内膜動態研究室
20. 大阪大学 先導的学際研究機構(OTRI) 生命医科学融合フロンティア研究部門
DOI:https://doi.org/10.1681/ASN.0000000000000414
参考URL
山本 毅士 特任助教(常勤)研究者総覧
https://rd.iai.osaka-u.ac.jp/ja/44d6ff1f0b8a80e4.html?k=%E5%B1%B1%E6%9C%AC
用語説明
- 転写因子
DNAに配列特異的に結合することで、mRNAの発現を開始・停止させる、あるいはその量を増加・減少させるタンパク質の一群。
- 虚血再灌流モデル
腎動脈・腎静脈を一定時間遮断したのち、血流を再開することで腎傷害を引き起こす実験手法。
- オートファジー
細胞構成成分を分解し、エネルギーの再利用や細胞内小器官の修復に携わる。分解基質がオートファゴソームという二重膜小胞に隔離され、分解酵素に富むリソソームに融合することで分解が生じる。
- Rubicon
Run domain Beclin-1 interacting and cysteine-rich containing protein。吉森教授らがオートファジー抑制因子として2009年に発見したオートファジーを抑制する働きを持つタンパク質である。オートファゴソームの成熟を負に制御している。
- TFEB
Transcription Factor EB。リソソーム機能やミトコンドリア機能を制御する。MondoAは哺乳類などの動物で細胞内シグナル伝達に関与するタンパク質キナーゼmTORを抑制してTFEBを活性化する。
- 近位尿細管
腎臓は主に糸球体と尿細管から構成される。糸球体でろ過された血液は原尿となり、近位尿細管・遠位尿細管・集合管からなる尿細管で水分や電解質、栄養素などの再吸収が行われ、尿として体外に排泄される。なかでも近位尿細管は糖やアミノ酸、アルブミンなどの再吸収を担っており、エネルギー代謝が盛んで、また虚血再灌流傷害などのストレスにさらされやすいことから、オートファジーが重要な役割を果たす。
