細胞内の“工場”ゴルジ体の 酸性バランスを保つ仕組みを解明
Oxr1 とNcoa7によるV-ATPaseの抑制が鍵
研究成果のポイント
- 細胞内小器官のゴルジ体内の過度な酸性化(pHの低下)を防ぎ、酵素反応に最適な環境を維持するメカニズムを解明。
- Oxr1とNcoa7タンパク質がV-ATPaseの活性を抑制することによるpHの制御が、ゴルジ体内におけるタンパク質への正常な糖鎖付加に重要であることを明らかにし、細胞内輸送やタンパク質品質管理におけるpH調節の重要性を示した。
- ゴルジ体内のpH制御の仕組みを初めて明らかにした今回の研究成果は、OXR1遺伝子の変異に起因する疾患と、これまで知られていた先天性グリコシル化異常症(CDG)との関連を示唆しており、ゴルジ体の機能不全(糖鎖修飾異常など)に起因するこれらの疾患の発症機構の解明への貢献および新たな治療法開発への手がかりとなることが期待される。
概要
大阪大学大学院医学系研究科の吉村信一郎講師ら(細胞生物学)は、細胞内小器官の一つであるゴルジ体内のpHを維持する新たな機構を明らかにしました。
ゴルジ体やリソソーム内腔の酸性環境維持には、液胞型プロトンポンプであるV-ATPaseが関与することが知られています。しかしながらゴルジ体内のpH (pH 6.0-6.7)はリソソーム内 (pH 4.5-5.0)に比べて弱酸性であり、その理由については不明でした。
今回、研究グループは、Oxr1とNcoa7タンパク質がゴルジ体膜上のV-ATPaseを抑制し、ゴルジ体内腔のpHの過度な低下を防ぐことにより、ゴルジ体内で起こる酵素反応に最適な環境を創出していることを発見しました。
今後は糖鎖修飾異常などゴルジ体の機能不全に起因する疾患の病態の理解につながることが期待されます。
本研究成果は、米国科学誌「Proceedings of the National Academy of Sciences of the United States of America」に、5月30日(日本時間)に公開されました。
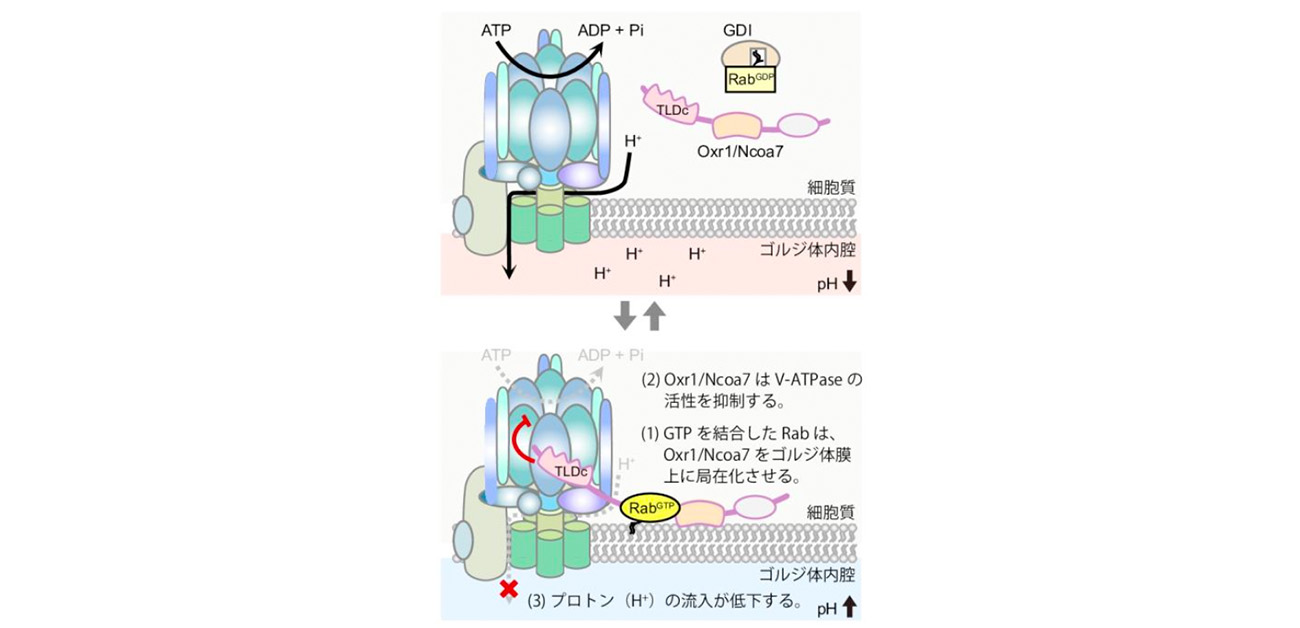
図. Oxr1とNcoa7はRabGTPに依存してゴルジ体膜に局在化する。Oxr1とNcoa7はそこでTLDcドメインを介してV-ATPase抑制し、内腔のpHの過度な低下を防ぐ。
研究の背景
細胞内小器官の内腔は、固有のpH環境を有することが知られています(例えば分泌経路においては、小胞体(pH7.1-7.2)、ゴルジ体(pH6.0-6.7)、リソソーム(pH4.5-5.0))。このような固有のpH環境は、それぞれの細胞内小器官内腔で起こるタンパク質への修飾や分解といった酵素反応に最適化されています。その中でも液胞型プロトンポンプであるV-ATPaseはゴルジ体やエンドソーム、リソソームなどさまざまな細胞内小器官に広く分布し、細胞内小器官の内腔を酸性化する役割を担っています。しかし、ゴルジ体内腔のpHがリソソームに比べて弱酸性に保たれている理由については、V-ATPaseの存在だけでは十分に説明ができず、長らく未解明のままでした。
研究の内容
今回、研究グループは、細胞内小器官間の物質輸送を制御するRabタンパク質に注目し、Rabタンパク質に結合する新たなタンパク質因子として、Oxr1とNcoa7を同定しました。Oxr1とNcoa7は相同なタンパク質であり、そのドメイン構造が類似していることから同様の機能を有すると考えられます。研究グループはさらに解析を進めた結果、Rabタンパク質がOxr1とNcoa7をゴルジ体膜上に局在化させ、Oxr1とNcoa7はそれらタンパク質内部のTLDcドメインを介してゴルジ体膜上のV-ATPaseの活性を抑制し、ゴルジ体内腔のpHの過剰な低下を防いでいることを明らかしました(図)。さらに遺伝子改変技術を用いてOxr1とNcoa7タンパク質の発現を抑制した細胞では、ゴルジ体内腔のpHが正常より低下した結果、ゴルジ体内腔で起こるタンパク質への糖鎖付加が抑制されることが明らかになりました。
本研究成果が社会に与える影響(本研究成果の意義)
ゴルジ体におけるpHの制御と糖鎖修飾の関係は、細胞機能や疾患発症との関連から注目されています。特に、糖鎖修飾の異常は神経系疾患や先天性疾患の一因となることが知られており、ヒトではOXR1 遺伝子の変異が神経疾患を引き起こすことが報告されています(J. Wang. et al. Am. J. Hum. Genet. 105, 1237-1253, 2019)。今回研究グループはOxr1及びNcoa7の発現抑制によりゴルジ体におけるタンパク質への糖鎖修飾異常を見出しました。このことはOXR1 遺伝子の変異に起因する疾患と、これまで報告のあった先天性グリコシル化異常症(CDG)との関連を示唆しています。本研究成果が当該疾患の発症機構の解明に貢献すると期待されます。
特記事項
本研究成果は、2025年5月30日 (日本時間)に米国科学誌「Proceedings of the National Academy of Sciences of the United States of America」(オンライン)に掲載されました。
タイトル:“Oxr1 and Ncoa7 regulate V-ATPase to achieve optimal pH for glycosylation within the Golgi apparatus and trans-Golgi network”
著者名:Shin-ichiro Yoshimura(責任著者), Tomoaki Sobajima, Masataka Kunii and Akihiro Harada
DOI:https://www.pnas.org/doi/10.1073/pnas.2505975122
なお、本研究は、日本学術振興会科学研究費基盤研究B(19H03181)及び基盤研究C(25K09614)の一環として、また武田科学振興財団の支援の元、大阪大学 大学院医学系研究科 原田彰宏研究室(細胞生物学)において行われました。
参考URL
用語説明
- ゴルジ体
細胞内小器官の一つ。分泌経路において小胞体から送られてきたタンパク質に対して糖鎖や硫酸基等の修飾を行いタンパク質に機能を与える役割を担う。さらに次の目的地にそれらのタンパク質を送り出す機能がある。
- V-ATPase
細胞質のV1部分と膜貫通のV0部分から構成されるプロトン(H+)ポンプ複合体。ATPの加水分解と共役して細胞内小器官内腔にプロトンを送り込み、細胞内小器官内腔に酸性環境をもたらす。今回の研究で同定したOxr1とNcoa7は、V-ATPase のV1部分に作用してATPの加水分解を抑制する。
- 先天性グリコシル化異常症
congenital disorders of glycosylation; CDG。先天性代謝異常の一種で、タンパク質や脂質への正常な糖鎖付加の不全の結果、乳児期より神経系、筋肉、消化器系に様々な異常を生じる。頻度が高いタイプは厚生労働省の「指定難病」として認定されている。
- Rabタンパク質
グアニンヌクレオチドと結合する性質を持ち、GTPを結合した状態(活性型)とGDPが結合した状態(不活性型)が存在する。哺乳類では約60種類のRabが知られており、それぞれが様々な細胞内小器官に局在している。GTP結合型のRabタンパク質は、特異的なRab結合タンパク質(エフェクター)を細胞内小器官膜上に局在化させる。今回の研究では、Oxr1とNcoa7がエフェクターとして同定された。
