神経系を起点とするオートファジー・寿命制御ネットワークを解明
研究成果のポイント
概要
大阪大学大学院生命機能研究科の大学院生 塩田達也さん(細胞内膜動態研究室)、吉森保教授(生命機能研究科細胞内膜動態研究室/医学系研究科遺伝学)、奈良県立医科大学医学部医学科 生化学講座の中村修平教授らの研究グループは、モデル生物線虫を用いて、寿命延長に必須な神経系を起点としたオートファジー制御ネットワークを世界で初めて明らかにしました(図1)。
線虫を含む様々な生物種において、生殖機能の低下により寿命が伸びることが知られています。この分子メカニズムはよく分かっていませんでしたが、研究グループの中村らは、以前の研究で生殖細胞欠損に応じて活性化し、寿命延長の鍵を握る因子として転写因子MML-1を同定していました(Nakamura et al., Nat Commun, 2016)。MML-1は細胞内分解システムとして知られるオートファジーを活性化することで寿命の延長に必須の働きをしますが、どの組織のMML-1の働きが重要なのか、どのようにオートファジーを活性化し、個体の寿命を制御するのかなどよく分かっていませんでした。
今回、研究グループは、線虫を用いて寿命延長におけるMML-1の組織特異的な解析を行い、神経系のMML-1の活性化が全身の老化抑制・寿命延長に必須の働きをもつことを見出しました。さらに、神経系MML-1を起点とした全身でオートファジーの活性を制御する組織間ネットワークを明らかにしました。今後、神経系の転写因子MML-1を起点とする本ネットワークの理解が進むことで、健康寿命延長や加齢性疾患の治療への応用につながる可能性があります。
本研究成果は、米国科学誌「Proceedings of the National Academy of Sciences of the United States of America」に、9月19日(火)午前4時(日本時間)に公開されました。
なお、本研究は 大阪大学 大学院医学系研究科 神経内科学 池中建介助教、望月秀樹教授、東京工業大学 科学技術創成研究院 藤田尚信 准教授、新潟大学 大学院医歯学総合研究科 神吉 智丈 教授、立教大学 理学部 岡敏彦教授、Max Planck Institute for Biology of Ageing, Adam Antebi教授との共同研究で行われました。
図1. 研究成果概略
神経系のMML-1はGLT-5の転写を促進させ、全身レベルでのオートファジー活性化・活性酸素の蓄積抑制をすることで、線虫の寿命を延長させる
研究の背景
虫やネズミのようにわずか数年しか生きられない生物がいる一方で、ゾウやカメのように100年近く、あるいはそれ以上生き続けることができる生物も知られています。このように多種多様な生物の寿命ですが、実際にどのように決まっているのかはまだほとんど分かっていません。しかし最近、線虫やハエなどの小さなモデル生物を用いた研究によって、特定の遺伝子の制御や環境下において生物の寿命が延びる寿命延長経路が存在することが分かってきました。例えば、線虫において将来精子や卵になる生殖細胞を除去すると寿命が約60%延長することが示されています。以前、研究グループの中村らはこの寿命延長を引き起こす鍵因子として転写因子MML-1を同定していました(Nakamura et al., Nat Commun, 2016)。MML-1は生殖細胞除去により活性化し、オートファジーの活性化を介して線虫の寿命の延長に寄与しています。重要なことに、MML-1は生殖細胞除去だけに限らず、カロリー制限等これまでに報告されているその他多くの寿命延長経路でも必須であることが明らかになりました。これらのことから、MML-1によるオートファジーの制御は多くの寿命延長経路のコアメカニズムの一つであると考えられます。
最近の老化研究から、特定の組織が、いわば高次の「コントロールセンター」として寿命を制御していることが分かってきました。生殖細胞欠損によるMML-1の活性化は全身レベルで起こりますが、どの組織のMML-1の働きが寿命制御に中心的な役割を担っているかは明らかにされていませんでした。また、MML-1によるオートファジーや寿命制御の詳細なメカニズムもよく分かっていませんでした。
研究の内容
本研究グループは、まず組織ごとにMML-1をノックダウンし、生殖細胞欠損による寿命延長への影響を調べました。すると、神経系でMML-1をノックダウンするだけで寿命延長効果が完全に打ち消されることが分かりました(図2)。また、神経系でMML-1がないと加齢に伴う易凝集蛋白質の蓄積、運動機能や腸管機能の低下が加速することも確認されました(図2)。さらに、生殖細胞を除去せずとも、神経系でMML-1を活性化させるだけでも線虫の寿命が延びることを見出しました。
次に、この老化・寿命制御の詳細を明らかにするために、神経系MML-1によって制御される因子をRNA-seqによって探索したところ、神経系MML-1がグルタミン酸トランスポーター(GLT-5)を制御することで寿命を伸ばしていることを発見しました(図3)。長寿個体の神経系でMML-1やGLT-5をノックダウンすると、神経系だけでなく腸や筋肉などの遠位組織のオートファジー活性までもが低下することが観察されました(図4)。さらに、神経系MML-1-GLT-5軸はペルオキシダーゼMLT-7の全身レベルでの活性化にも寄与しており、これがオートファジー活性とは独立して、加齢に伴う活性酸素種の蓄積を抑制することで寿命延長に貢献していることも見出しました(図5)。これらの結果は、神経系MML-1-GLT-5軸が組織間ネットワークを介して全身レベルでオートファジー活性化や酸化ストレスを軽減することで老化を抑制していることを示唆するものです。
図2. 神経系MML-1の抑制により線虫の長寿が廃止される
(左)生殖細胞除去個体の神経系でMML-をノックダウン(ピンク線)すると寿命が延長しなくなる。
(右)神経系MML-1をノックダウンにより生殖細胞除去個体の腸管バリアが破れ、餌に混ぜた青色染料が腸管の外に漏れ出る。
図3. 神経系MML-1はGLT-5を発現上昇させることで寿命を延ばす
(左)長寿な線虫では神経系MML-1によりGLT-5の発現が上昇する。
(右)神経系でGLT-5をノックダウン(水色)すると生殖細胞除去個体の長寿が廃止される。
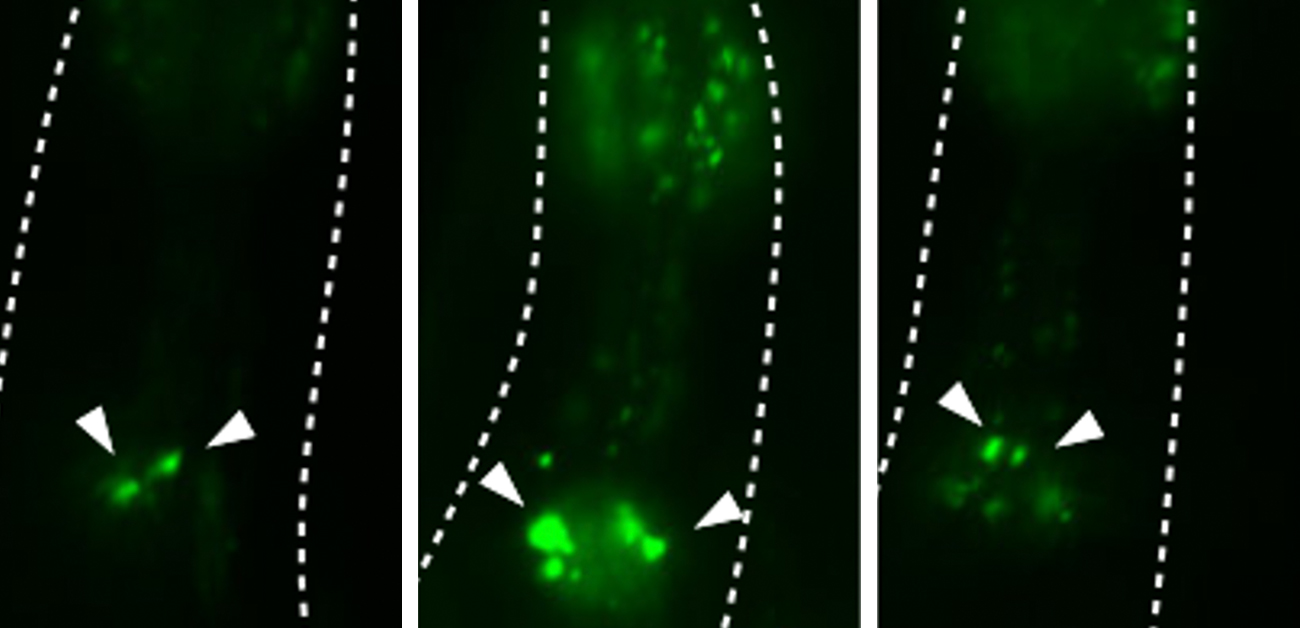
図4. 神経系MML-1は遠位組織のオートファジーを制御する
オートファゴソームとリソソームの融合を阻害するクロロキンを用いて一定の期間に形成されるオートファゴソームの数を測定する実験。神経系でMML-1をノックダウンすると、腸で形成されるオートファゴソームの数が低下しており、オートファジー活性が低下していることが分かった。
図5. 神経系MML-1はMLT-7を活性化し、活性酸素の蓄積を抑制する
(左上)神経系MML-1をノックダウンすると、生殖細胞除去個体のMLT-7の発現上昇が見られなくなる。
(右上)生殖細胞除去個体でMLT-7を抑制すると(紫線)寿命が延長しなくなる。
(下)MLT-7をノックダウンすると生殖細胞除去個体で活性酸素(赤色)の蓄積が増加する。
本研究成果が社会に与える影響(本研究成果の意義)
本研究成果により、個体寿命の制御における神経系を起点とした組織間ネットワークの一端を明らかにすることができました。神経系MML-1をターゲットにした新たなオートファジーの活性調節やこれに伴う健康寿命延長法確立への貢献が期待されます。
特記事項
本研究成果は、米国科学誌「Proceedings of the National Academy of Sciences of the United States of America」に、9月19日(火)午前4時(日本時間)に公開されました。
タイトル:”Neuronal MML-1/MXL-2 regulates systemic aging via glutamate transporter and cell non-autonomous autophagic and peroxidase activity”
著者名:Tatsuya Shioda1, Ittetsu Takahashi1, Kensuke Ikenaka2, Naonobu Fujita3, 4, Tomotake Kanki5, Toshihiko Oka6, Hideki Mochizuki2, Adam Antebi7, 8, Tamotsu Yoshimori1, 9, 10*, Shuhei Nakamura11* (*責任著者)
所属:
1 Laboratory of Intracellular Membrane Dynamics, Graduate School of Frontier Biosciences, Osaka University, Osaka, Japan
2 Department of Neurology, Graduate School of Medicine, Osaka University, Osaka, Japan
3 Cell Biology Center, Institute of Innovative Research, Tokyo Institute of Technology, Yokohama 226-8503, Japan
4 Graduate School of Life Science and Technology, Tokyo Institute of Technology, Yokohama 226-8503, Japan
5 Department of Cellular Physiology, Graduate School of Medical and Dental Sciences, Niigata University, Niigata, Japan
6 Department of Life Science, Rikkyo University, Tokyo, Japan
7 Department of Molecular Genetics of Ageing, Max Planck Institute for Biology of Ageing, Cologne 50931, Germany
8 Cologne Excellence Cluster on Cellular Stress Responses in Aging Associated Diseases, University of Cologne, Cologne 50931, Germany
9 Department of Genetics, Graduate School of Medicine, Osaka University, Osaka, Japan
10 Integrated Frontier Research for Medical Science Division, Institute for Open and Transdisciplinary Research Initiatives (OTRI), Osaka University, Osaka, Japan
11 Department of Biochemistry, Nara Medical University, Nara, Japan
DOI:https://doi.org/10.1073/pnas.2221553120
なお、本研究は、日本医療研究開発機構(AMED)革新的先端研究開発支援事業(AMED-CREST)研究開発領域「プロテオスタシスの理解と革新的医療の創出」における研究課題「細胞内膜動態によるプロテオスタシス制御の理解:健康長寿の実現に向けて」(研究代表者:吉森保)「JP22gm1410014」、日本学術振興会基盤研究S「疾患と老化に対抗するオートファジーの分子機構と制御因子の作動原理の解明」(研究代表者:吉森保)「22H04982」、AMED革新的先端研究開発支援事業(PRIME)「全ライフコースを対象とした個体の機能低下機構の解明」における研究課題「生殖腺によるオートファジー活性化を介した寿命制御機構の解明」(研究代表者:中村修平)「20gm6110003」、文部科学省学術変革領域研究B「TFEB依存的・非依存的ポストリソソームシグナルによる個体および生殖寿命制御機構」(研究代表者:中村修平)「21H05145」、日本学術振興会挑戦的研究(萌芽)「神経系オートファジーによる寿命延長機構の解明研究課題」(研究代表者:中村修平)「19K22429」、日本学術振興会特別研究員奨励費「神経系ヒストンバリアントによる寿命延長メカニズムの解明」(研究代表者:塩田達也)「22KJ2165」の一環として行われました。
参考URL
大阪大学 大学院医学系研究科 遺伝学/生命機能研究科 細胞内膜動態学
http://www.fbs.osaka-u.ac.jp/labs/yoshimori/jp/
奈良県立医科大学 医学部医学科 生化学講座
https://www.naramed-u.ac.jp/~bioch/
https://bioch.naramed-u.ac.jp/
新潟大学 大学院医歯学総合研究科・機能制御学分野
https://www.med.niigata-u.ac.jp/mit/
SDGSの目標
用語説明
- 転写因子
複数の遺伝子の発現を制御するタンパク質のこと。DNA上の特定の配列に結合して、その近傍に書き込まれた遺伝子のRNAへの転写を促進したり抑制したりする機能を有する。
- オートファジー
細胞内のタンパク質や構造体をオートファゴソームと呼ばれる脂質二重膜で包み込み、リソソーム(多量の消化酵素をもつ細胞小器官)と融合することで内容物を分解・除去する機構のこと。オートファジーの異常は神経変性疾患や2型糖尿病などの重篤な疾患を引き起こすほか、老化にまで影響することが近年の研究で分かってきている。
- ペルオキシダーゼ
過酸化水素(H2O2)の分解を担う酸化還元酵素の一種。細胞内の活性酸素を除去する生体防御機構の一端を担っている。
- 線虫
正式にはCaenorhabditis elegansと呼ばれる線形動物の一種。体長は1mmほどで、体が透明であることから生きたまま細胞の中を観察することが可能であり、モデル生物として広く利用されている。神経系や腸、筋肉、皮膚などの高度な組織を有しているにも関わらず、寿命が約20日と短いため、老化・寿命の研究に適している。
- RNA-seq
次世代シーケンサーを用いてサンプル内の全転写産物の塩基配列を決定する手法のこと。

