レム睡眠を誘導する神経回路を解明し「夢を演じる病」の原因を特定
研究成果のポイント
夢を盛んに見ることで知られる睡眠であるレム睡眠を誘導する神経回路を解明するとともに、この神経回路を構成する神経細胞の異常によって、レム睡眠中に、見ている夢の通りに体が動くレム睡眠行動障害が引き起こされることを突き止めました。
概要
レム睡眠中には、夢を盛んに見ます。しかしながら、レム睡眠がどのようにして誘導されるかはよく分かっていませんでした。一方、レム睡眠の異常は、さまざまな疾患に先駆けて起こります。特に、レム睡眠中に、見ている夢の通りに体が動いたり声が出たりするレム睡眠行動障害は、パーキンソン病等の神経変性疾患の前駆症状として注目されていますが、なぜこうした異常が生じるかは謎でした。
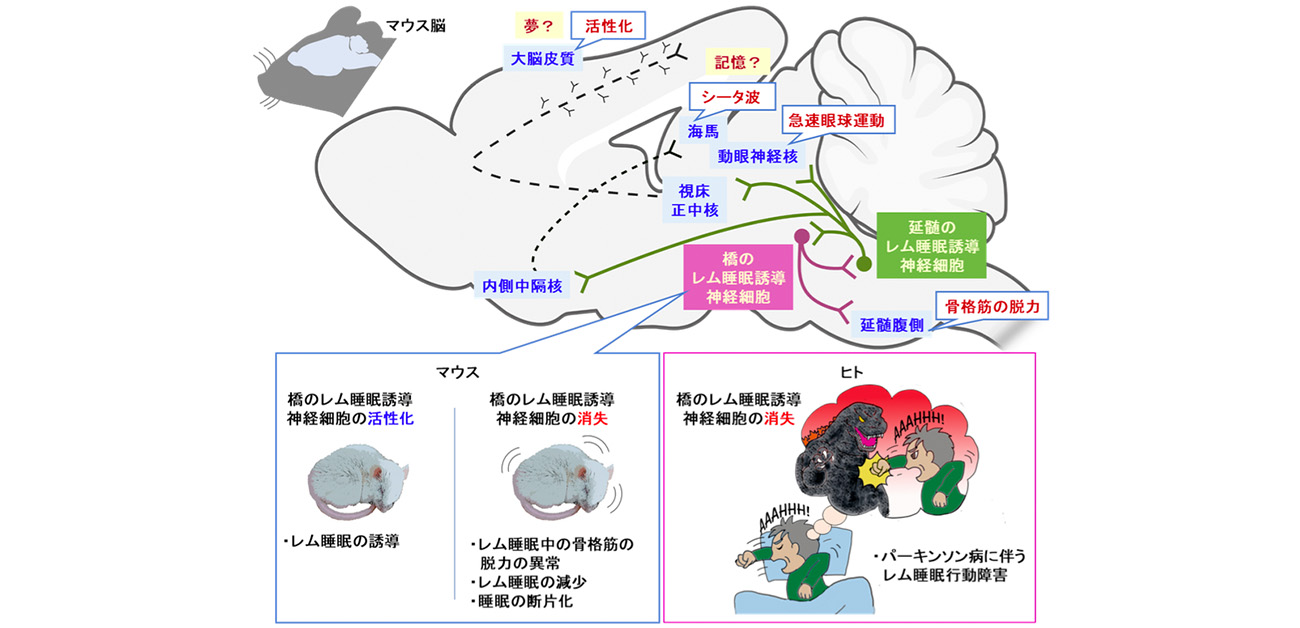
本研究では、レム睡眠を誘導する神経細胞として、脳の橋(きょう)と延髄(いずれも脳幹の一部)にある2種類の神経細胞を同定しました。これらの神経細胞が形成する神経回路は、レム睡眠時に特徴的な大脳皮質の活性化や急速眼球運動、筋肉の脱力等を制御する脳部位と接続しており、同定した神経回路を人為的に活性化すると、起きているマウスが直接レム睡眠に移行するなど、極めて強力にレム睡眠を誘導する作用がありました。
さらに、橋のレム睡眠誘導細胞の働きを抑えたマウスでは、レム睡眠中に体が動き出したり、レム睡眠そのものが大きく減少したりと、パーキンソン病の患者と似たレム睡眠異常を示しました。実際、レム睡眠行動障害を併発するパーキンソン病患者では、橋のレム睡眠誘導細胞が減少していることが判明し、レム睡眠行動障害の原因の一端が明らかとなりました。
今回の発見は、レム睡眠や夢の仕組みと意義への理解を深め、睡眠障害および関連疾患の新たな予防・治療法の開発に役立つと期待されます。
図. 本研究成果の要約
研究の背景
ヒトは寝ている間、ノンレム睡眠とレム睡眠という大きく異なる2つのステージを行き来します。レム睡眠は、①急速眼球運動(rapid eye movement; REM)が起こる、②大脳皮質が活性化し、夢を見る、③骨格筋の筋活動が低下して脱力する、④海馬の神経活動により特徴的な脳波(シータ波)が出現する、といった特徴があります。しかしながら、このような独特な生理状態が何のためにあるのか、また、どのような仕組みで生じるのかは脳科学における大きな謎でした。
また、レム睡眠の異常は、さまざまな疾患や不調の前兆としても知られ、例えば、レム睡眠が少ないと、認知症発症や、循環器疾患による死亡のリスクが高まります。特に近年、パーキンソン病の前駆症状として注目されているのが、レム睡眠中に夢の内容通りに体が動いたり声が出たりしてしまい、本人や家族が負傷する原因にもなりうるレム睡眠行動障害です。これを発症すると、その後10年以内にパーキンソン病等のαシヌクレイノパシーを発症する確率が非常に高くなります。パーキンソン病では、多くの患者でレム睡眠そのものが失われていきますが、その原因や、レム睡眠の消失が脳にもたらす作用は不明でした。
研究の内容
本研究では、まず、マウスを用いた実験により、脳の橋(きょう)と延髄と呼ばれる部位においてそれぞれ、強力にレム睡眠を誘導する神経細胞を同定するとともに、これら2種類の神経細胞が、互いに投射し合うループ回路を形成することを発見しました。また、2種類の神経細胞のうち、延髄にあるレム睡眠を誘導する神経細胞は、急速眼球運動を担う脳領域(動眼神経核)、大脳皮質の活性化を担う脳領域(視床正中核)、海馬シータ波の生成を担う脳領域(内側中隔核)へと、神経接続を形成していました。橋にあるレム睡眠を誘導する神経細胞は、脊髄を介して骨格筋を制御する運動神経につながる回路を形成していました。レム睡眠ではこれらの回路が働くことで、大脳皮質が活発に活動して夢を見る一方で、骨格筋を制御する神経細胞への抑制性の信号がいくことによって、筋肉の脱力が保たれるため、夢を見ていても体は動かないというメカニズムが示唆されました。実際に、マウスにおいて、橋のレム睡眠誘導細胞のみを失わせると、レム睡眠中にも体が動くようになり、レム睡眠の量そのものも大幅に減少しました。
続いて、ヒトの死後脳についても調べたところ、ヒトにも、マウスと同様に、レム睡眠誘導神経細胞があることが分かりました。また、レム睡眠行動障害とパーキンソン病を併発していた患者の死後脳を調べたところ、橋のレム睡眠誘導神経細胞の数が激減していました。さらに、レム睡眠誘導神経細胞は、パーキンソン病の原因物質として知られる凝集αシヌクレインという異常タンパク質を蓄積しやすいことも判明しました。これらのことから、パーキンソン病に伴うレム睡眠行動障害などのレム睡眠異常の原因が、橋のレム睡眠誘導神経細胞の減少であることが分かりました。
今後の展開
本研究成果により、パーキンソン病の発症メカニズムの解明や、レム睡眠の質・量の低下に注目した予防・治療法への応用の他、夢を見る仕組みや意義の理解が進むと期待されます。また、今回同定されたレム睡眠を誘導する神経回路が具体的にどのように脳機能に影響を与えるかを調べることで、レム睡眠の意義の解明が大きく前進すると考えられます。
特記事項
【論文情報】
【題 名】 A pontine-medullary loop crucial for REM sleep and its deficit in Parkinson’s disease
(レム睡眠に必須な橋-延髄回路およびパーキンソン病におけるその回路の異常の発見)
【著者名】 Mitsuaki Kashiwagi, Goichi Beck, Mika Kanuka, Yoshifumi Arai1,Kaeko Tanaka, Chika Tatsuzawa, Yumiko Koga, Yuki C. Saito, Marina Takagi, Yo Oishi, Masanori Sakaguchi, Kousuke Baba, Masashi Ikuno, Hodaka Yamakado, Ryosuke Takahashi, Masashi Yanagisawa, Shigeo Murayama, Takeshi Sakurai, Kazuya Sakai, Yoshimi Nakagawa, Masahiko Watanabe, Hideki Mochizuki, Yu Hayashi* (*責任著者)
【掲載誌】 Cell
【掲載日】 2024年9月20日
【DOI】 10.1016/j.cell.2024.08.046
本研究は、世界トップレベル研究拠点プログラム(WPI)、AMED革新的先端研究開発支援事業(AMED-CREST)「睡眠の質の変化が引き起こす個体の機能低下~睡眠構築の操作によるメカニズムの解明と応用~」(JP18gm1110008)、脳とこころの研究推進プログラム(精神・神経疾患メカニズム解明プロジェクト)「レム睡眠からアプローチする精神・神経疾患の理解とその克服」(JP21wm0425018)、AMEDムーンショット型研究開発事業「睡眠と冬眠:2つの「眠り」の解明と操作が拓く新世代医療の展開」(JP21zf0127005)、AMED脳とこころの研究推進プログラム(革新的技術による脳機能ネットワークの全容解明プロジェクト)「パーキンソン病発症前から発症後に連続する神経回路病態の解明とトランスレータブル指標の開発」(JP21dm0207070)、AMED脳とこころの研究推進プログラム(精神・神経疾患メカニズム解明プロジェクト)「日本ブレインバンクネット(JBBN)による精神・神経疾患死後脳リソース基盤の強化に関する研究開発」(JP21wm0425019)、AMED脳科学研究戦略推進プログラム「日本ブレインバンクネットの構築」(JP16dm017106)、および科研費による研究プロジェクト(JP20K22674、JP21K15179、JP20K06910、JP23H04210、JP16H06280、JP16H06277、JP23H04668)の一環として実施されました。
SDGsの目標
用語説明
- レム睡眠
全睡眠時間の約15~20%を占める睡眠。1953年に報告され、急速眼球運動(rapid eye movement; REM)を伴うことから、レム睡眠と名づけられた。レム睡眠中は、寝ているにも関わらず、脳が活性化し、特に、思考を担う大脳皮質や情動を担う扁桃体、記憶を司る海馬等の脳部位が活発に活動し、鮮明な夢を生じる。一方で、主要な骨格筋が脱力するため、通常は夢の通りに体が動き出すことはない。
- パーキンソン病
脳のいくつかの特定部位が次第に変性し、さまざまな症状をもたらす神経変性疾患。高齢化に伴い、急速に有病率が増加している。近年、運動症状よりも早い段階から見られるレム睡眠行動障害が、早期バイオマーカーとして注目されている。
- αシヌクレイノパシー
パーキンソン病等の、凝集αシヌクレインが蓄積する神経変性疾患の総称。パーキンソン病以外に、レビー小体型認知症や多系統萎縮症が挙げられる。
- 橋(きょう)と延髄
いずれも脳幹を構成する脳部位であり、呼吸や血圧の制御など生命の維持に重要な役割を果たす神経細胞が密に存在する。



