パーキンソン病の異常タンパク質がひろがる仕組み
リソソームの破裂とリソファジーの機能低下が異常を拡大する
研究成果のポイント
概要
大阪大学大学院医学系研究科 角田渓太 特任助教(常勤)、望月秀樹教授(神経内科学)および吉森保教授(遺伝学)らの研究グループは、パーキンソン病の原因として注目される異常なαシヌクレインのひろがりに①リソソーム膜の破裂と②破裂したリソソームの除去機能の低下という2つの条件が重要であることを明らかにしました。
これまでにパーキンソン病患者の脳内では、αシヌクレインというタンパク質が異常となり、異常なαシヌクレインが細胞間を伝わり、次の細胞の正常なαシヌクレインを異常にしてしまい、脳内でどんどんとαシヌクレインの異常がひろがっていくことが知られていました。しかし、異常αシヌクレインは正常αシヌクレインが存在する細胞質からは膜で隔てられたリソソーム内に取り込まれるため、どのようにして異常が細胞質の正常なαシヌクレインへ伝えられるかは不明でした。(図1)
今回、研究グループは異常αシヌクレインを取り込んだリソソーム膜の破裂(①)と破裂したリソソームの除去機構(リソファジー)の機能低下(②)という2つの条件が、αシヌクレインの異常が細胞間を伝わる際に重要であることを明らかにしました。(図2)
この成果により、さらなるパーキンソン病の病態の解明やリソファジーの活性化という新たな観点からの治療開発研究に繋がることが期待されます。
本研究成果は、米国科学誌「Proceedings of the National Academy of Sciences (PNAS)」(オンライン)に、2023年12月26日(火)に公開されました。
図1. 研究背景
図2. 今回の研究成果
研究の背景
これまでにパーキンソン病患者の脳内では1. 神経細胞にあるαシヌクレインというタンパク質が異常な構造になってしまい、凝り固まった構造=凝集体を作って蓄積していること、2. 異常αシヌクレイン凝集体は細胞間を伝わり、次の細胞に存在する正常なαシヌクレインを異常な構造に変換してドミノ倒しのように脳内で異常αシヌクレインがひろがることが知られていました。またαシヌクレインの遺伝子に異常を持っている方はαシヌクレインが異常構造をとりやすく、遺伝性のパーキンソン病を発症することが知られており、このαシヌクレインの異常のひろがりこそがパーキンソン病の病態の本質と考えられてきました。
しかしながら遺伝子異常をもっていない大部分のパーキンソン病患者において、αシヌクレインの異常がどのように起こるのかはいまだ十分には解明されていません。特に神経細胞間でαシヌクレインの異常が伝わる仕組みについては不明な点が多く残されています。これまでに異常αシヌクレインはエンドサイトーシスという仕組みで細胞内にとりこまれることは知られていました。しかし、エンドサイトーシスされた物質は正常なαシヌクレインが存在する細胞質からは膜1枚隔てられているリソソームという細胞内小器官の中に集まります。リソソームは細胞の中で不要な物質を分解する場所として知られており、どのようにして取り込まれた異常なαシヌクレイン凝集体が分解の場であるリソソームを抜け出して、細胞質にある正常なαシヌクレインへ異常な凝集を伝えるかは不明でした。(図1)
研究の内容
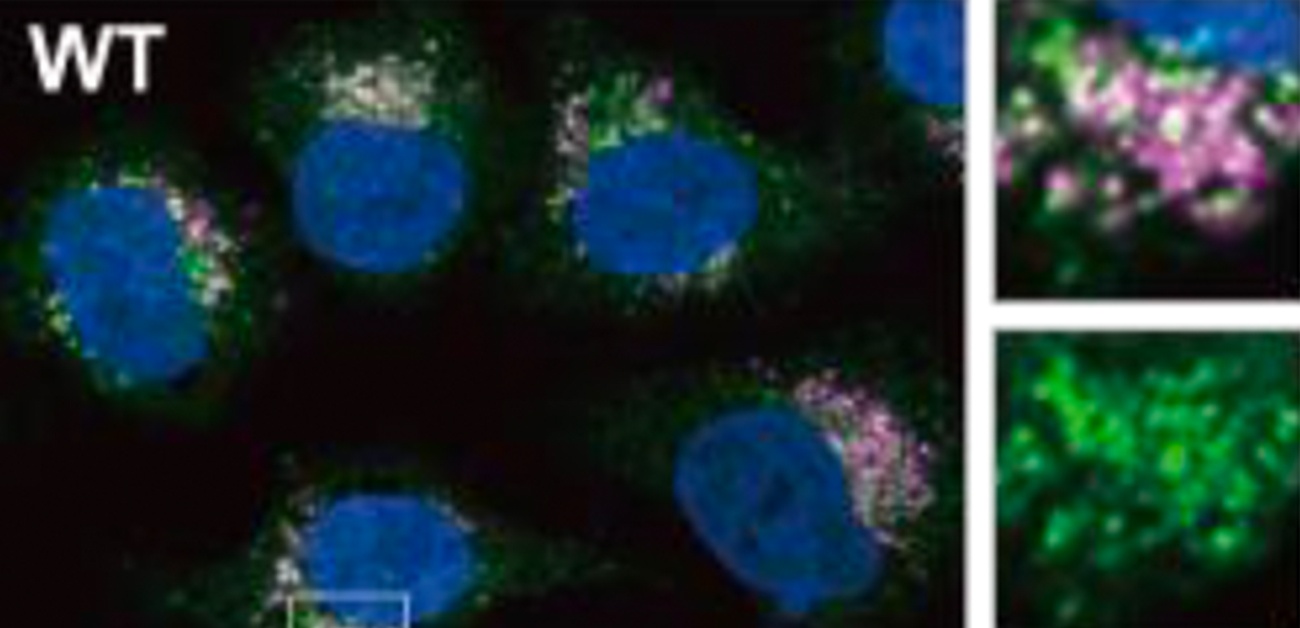
研究グループはαシヌクレインの異常が細胞間で伝わる仕組みを解明するために、培養細胞に対して人工的に作成したαシヌクレインの凝集体を投与し、細胞内の正常αシヌクレインが異常構造に変換され凝集が始まる様子(凝集の伝播)を可視化し、凝集の伝播に必要な条件を詳細に検討しました。その結果、正常なαシヌクレインの凝集は人工αシヌクレイン凝集体を取り込んだリソソームの近くで始まることが分かりました(図3)。また異常αシヌクレイン凝集体はリソソーム膜を破る性質を有しており、さらにLLOMeというリソソーム膜を破綻させる薬剤を併せてαシヌクレイン凝集体と併せて投与すると、凝集の伝播が促進されることが分かりました。これらの結果から凝集の伝播は異常αシヌクレインが取り込まれたリソソーム膜を破り細胞質へ脱出することで起こることが示されました。
研究グループは損傷したリソソームがオートファジーという仕組みで細胞質から隔離されて除去されることを以前に発見し、リソファジーとして報告していました。( https://resou.osaka-u.ac.jp/ja/research/2022/20220915_2 )
異常αシヌクレインを投与した細胞ではこのリソファジーが誘導されることが確認され、リソファジーが異常αシヌクレインの破綻したリソソームからの脱出に防御的に働いていると考えられました。そこでリソファジーに必須の遺伝子FIP200をノックアウトした細胞(FIP200KO細胞)を用いた実験を行うと、確かに正常細胞(リソファジーあり)よりもFIP200KO細胞の方がαシヌクレインの凝集の伝播が起こりやすいことが確認されました。(図4)
さらにリソソーム膜の破綻とリソファジーの機能低下を同時に行うと相乗的にαシヌクレイン凝集の伝播が促進されることも発見しました。(図5)これらの成果からパーキンソン病の病態である異常αシヌクレインのひろがりには1.リソソーム膜の破綻と、2.リソファジーの機能低下が重要であることが示されました。
図3. 正常なαシヌクレインの凝集過程
図4. リソファジーはαシンクレイン凝集の伝播を防御する
図5. リソソームの膜破綻とリソファジーの機能低下がαシヌクレイン凝集の伝播を相乗的に促進する
本研究成果が社会に与える影響(本研究成果の意義)
本研究成果により、パーキンソン病のαシヌクレインの異常が細胞内で伝わる仕組みとそれに対する防御機構(リソファジー)が明らかになりました。この知見を生かして異常αシヌクレインが伝播する仕組みの更なる研究やリソファジーの活性化という新たな観点からの治療研究に繋がることが期待されます。
特記事項
本研究成果は、2023年12月26日(日本時間)に欧州科学誌「Proceedings of the National Academy of Sciences (PNAS)」(オンライン)に掲載されました。また本研究の画像が掲載号のCover image(表紙)に選出されました。また同PNAS121巻3号では本研究に関するCommentaryが掲載されました。
タイトル:“Lysophagy protects against propagation of α-synuclein aggregation through ruptured lysosomal vesicles”
著者名:Keita Kakuda1, Kensuke Ikenaka1*, Akiko Kuma2, Junko Doi1, César Aguirre1, Nan Wang1, Takahiro Ajiki1, Chi-Jing Choong1, Yasuyoshi Kimura1, Shaymaa Mohamed Mohamed Badawy1,3, Takayuki Shima2, Shuhei Nakamura4, Kousuke Baba1, 5 , Seiichi Nagano1, 5 , Yoshitaka Nagai6, Tamotsu Yoshimori2, Hideki Mochizuki1*(*責任著者)
所属:
1. 大阪大学 大学院医学系研究科 神経内科学講座
2. 大阪大学 大学院医学系研究科 遺伝学講座
3. ザガジグ大学 農学部 農業生化学
4. 奈良県立医科大学 生化学講座
5. 大阪大学 大学院医学系研究科 神経難病認知症探索治療学講座
6. 近畿大学 医学部 脳神経内科学教室
DOI:https://doi.org/10.1073/pnas.2312306120
本研究は、JST戦略的創造研究推進事業「細胞外微粒子に起因する生命現象の解明とその制御に向けた基盤技術の創出研究」、AMED-CREST「細胞内膜動態によるプロテオスタシス制御の理解:健康長寿の実現に向けて」およびAMED疾患基礎研究事業部「革新的技術による脳機能ネットワークの全容解明プロジェクト」の一環として行われました。
参考URL
池中建介助教 研究者総覧
https://researchmap.jp/kensukeikenaka
用語説明
- パーキンソン病
主に中年以降に発症する神経変性疾患で、手足のふるえや動作緩慢といった運動症状を呈する。アルツハイマー病についで二番目に多い神経変性疾患であり、本邦ではおよそ15~20万人が罹患している。
- αシヌクレイン
αSyn、脳や脊髄などの神経細胞内に豊富に発現している蛋白質で、これが神経細胞の中で変性し凝集体を形成することがパーキンソン病の病態に深く関与することが知られている。
- リソファジー
損傷を受けたリソソームがオートファジーという仕組みで二重の脂質膜(オートファゴソーム膜)に包まれて細胞質から取り除かれる機構であり、吉森保教授らのグループが2013年に報告した。
