細胞老化を促進するエクソソーム産生メカニズムを解明
細胞外小胞による老化制御技術の開発へ
研究成果のポイント
概要
大阪大学大学院医学系研究科の大学院生の栁川恭佑さん(博士後期課程)、保健学専攻 吉森保 特任教授(研究当時:教授 遺伝学/大学院生命機能研究科)らの研究グループは、老化を促進する新規のエクソソーム産生制御機構を発見しました(図1)。
細胞内分解系のオートファジーは細胞外小胞形成に関与することが報告されていました。しかし、細胞間コミュニケーションに重要であると注目される細胞外小胞のエクソソームとオートファジーの関連について、その詳細な分子機構や生理的意義は解明されていませんでした。
今回、研究グループは、オートファジー関連因子に対してエクソソーム産生制御因子の大規模スクリーニングを実施しました。その結果、オートファジーを抑制する因子であるRubiconがエクソソーム産生を促進することを発見し、その分子機構を解明しました。さらに、Rubiconを介して分泌されるエクソソームが老化促進マイクロRNAを内包し、細胞老化を促進することを明らかにしました。
これらの結果により、細胞外小胞を介した老化制御機構の理解が進み、新規の老化制御技術の開発につながることが期待されます。
本研究成果は、米国科学誌「Nature Cell Biology」に、8月22日(木)に公開されました。
図1. 本研究成果の新規エクソソーム産生メカニズムの概要
研究の背景
エクソソームは直径が約50-150nmの大きさの小細胞外小胞で、細胞内小器官であるエンドソームの内部に形成された内膜小胞に由来します。細胞外へ分泌されたエクソソームは、タンパク質、脂質、核酸などの内容物を受け手(レシピエント)細胞に輸送して、細胞間コミュニケーションに重要な役割を持つことが知られています。エクソソーム産生経路と同様にメンブレントラフィック経路である細胞内分解系のオートファジーは細胞外小胞形成に関与することが報告されていましたが、エクソソーム産生との関連についての詳細はわかっていませんでした。
また、近年はエクソソームの多様な生理作用に注目が集まっています。特にエクソソーム分泌は老化に関連することが報告されています。老化細胞は通常の細胞よりも多くエクソソームを分泌しており、老化細胞から分泌されたエクソソームは、レシピエント細胞の老化を促進することが知られています。しかし、なぜ老化細胞はエクソソームの分泌量が増加するのか、老化を促進する内容物をどのように放出しているのか、といった詳しい分子機構は解明されていませんでした。
研究の内容
研究グループは、細胞から分泌されたエクソソームを単離して、エクソソーム産生に必要な因子をスクリーニングする実験系を構築しました。オートファジーとエクソソーム産生との関連を調べるために、オートファジー関連因子に対して大規模スクリーニングを実施しました。
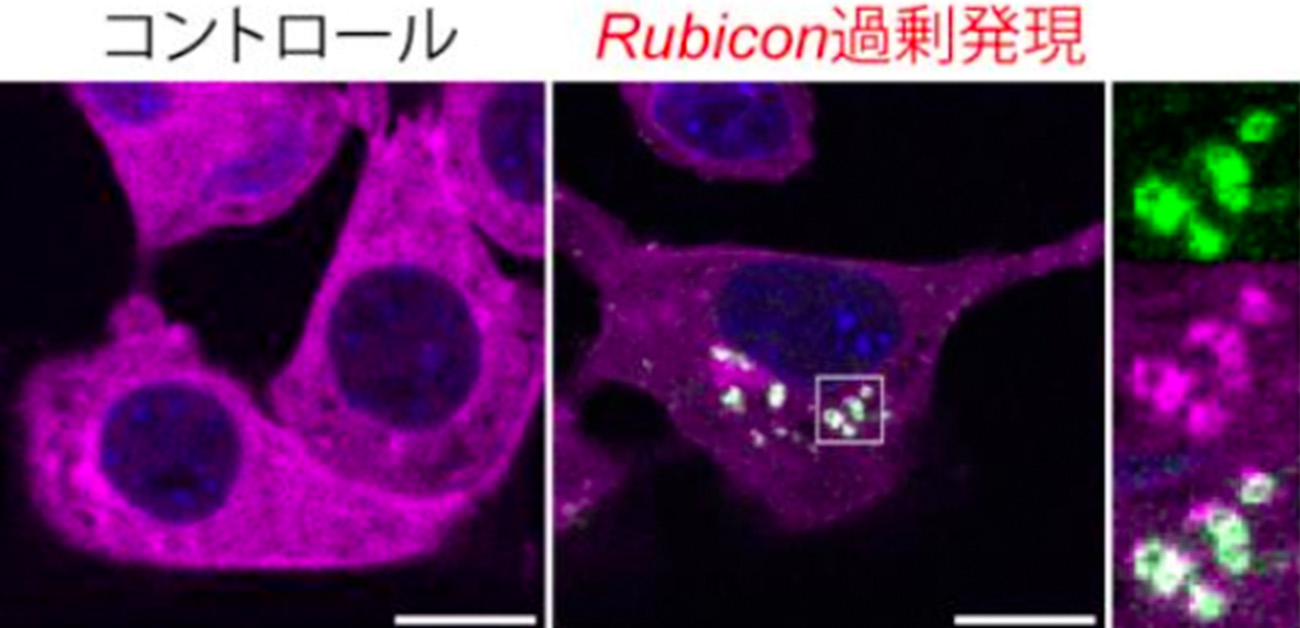
スクリーニングの結果、オートファジーの負の制御因子であるRubiconがエクソソーム産生を促進することを発見しました。Rubiconは、従来報告されていたオートファジーを抑制する機能と異なる新規経路でエクソソーム産生を制御していました(図2)。Rubiconの結合候補因子を共免疫沈降質量分析法で解析し、ホスホイノシチド3-リン酸結合タンパク質であるWIPI2がRubiconと共にエクソソーム産生を制御することを発見しました。RubiconはWIPI2をエンドソームにリクルートし、WIPI2は内膜小胞形成因子であるESCRT因子を介してエクソソーム産生を促進していました(図3)。またマウスの血中エクソソーム量を測定したところ、加齢と共に増加したRubiconによってエクソソーム産生が増加していることがわかりました。Rubiconを介して分泌されるエクソソームは老化促進マイクロRNAであるmiR-26aとmiR-486aを内包しており、レシピエント細胞の細胞老化を促進することを明らかにしました(図4)。
以上から、加齢と共に発現量が増加するRubiconはオートファジー抑制とは異なる機能で老化促進エクソソームの産生を促進して、細胞老化を促進させることが明らかになりました。
図2. Rubiconはオートファジーと異なる経路でエクソソーム産生を制御する
(左上) Rubicon欠損は単離したエクソソーム画分でのエクソソームマーカーが減少する。オートファジー経路での結合因子であるBeclin-1欠損ではエクソソームマーカーは減少しない。(左下)Rubicon欠損細胞ではナノパーティクルトラッキングアナリシスにおけるエクソソーム量が低下する。(右)エクソソーム誘導剤によってRubiconは多胞性エンドソームマーカーであるCD63を囲い込むように局在する。オートファジー不全あるいはBeclin-1欠損細胞でも同様であり、オートファジー経路を介さない反応である。
図3. RubiconはWIPI2をリクルートしてESCRT因子を介した内膜小胞形成を促進する
(左上) 共免疫沈降質量分析法によってエクソソーム産生誘導剤を使用した際にRubiconとの結合が増加する因子としてWIPI2とファミリータンパク質のWIPI3が同定される。(左下)WIPI2欠損細胞ではナノパーティクルトラッキングアナリシスにおけるエクソソーム量が低下する。(中央上)Rubicon過剰発現によってWIPI2はオルガネラへリクルートされる。(中央下)GFP-CD63を発現させた細胞でGFP抗体を用いた免疫電子顕微鏡で金コロイドをマーキングした内膜小胞を観察すると、Rubicon欠損によって内膜小胞を伴うエンドソームが減少している。これによってRubicon-WIPI2経路は内膜小胞形成を制御していることがわかる。(右上)共免疫沈降質量分析法でWIPI2との結合因子としてESCRT因子が同定される。
図4. Rubiconは加齢によるエクソソームの量と質の変化に必要である
(左上) 若齢、老齢のコントロールとRubicon欠損マウスから血清を採取してエクソソームを単離して解析を実施している。(左下)加齢によってマウス血清エクソソーム量が増加し、Rubicon欠損によって抑制される。(右上)エクソソーム内容物のスモールRNAシークエンス解析によって加齢に伴いRubicon依存的に増加するエクソソームマイクロRNAが10因子同定される。これらに細胞老化促進マイクロRNAであるmiR-26aとmiR-486aが含まれる。(右下)老化促進マイクロRNA過剰発現で細胞老化が促進される。
本研究成果が社会に与える影響(本研究成果の意義)
老化細胞が増えると個体老化が促進されることが分かっています。本研究成果をもとに、Rubiconの抑制によって老化促進エクソソーム産生を減らせば、個体老化も抑えることができるかも知れません。また、細胞外小胞を介した老化制御機構の理解が進み、新規のバイオマーカーの発見や新規の老化制御技術の開発につながることが期待されます。
特記事項
本研究成果は、2024年8月22日(日本時間)に米国科学誌「Nature Cell Biology」(オンライン)に掲載されました。
タイトル:“The Rubicon-WIPI axis regulates exosome biogenesis during ageing”
著者名:Kyosuke Yanagawa1,2, Akiko Kuma1,3, Maho Hamasaki1,4, Shunbun Kita5,6, Tadashi Yamamuro7, Kohei Nishino8, Shuhei Nakamura1,4,9,10, Hiroko Omori11, Tatsuya Kaminishi1,12, Satoshi Oikawa7,13, Yoshio Kato14, Ryuya Edahiro15,16, Ryosuke Kawagoe17, Takako Taniguchi17, Yoko Tanaka18, Takayuki Shima1,10, Keisuke Tabata1,4, Miki Iwatani1, Nao Bekku1, Rikinari Hanayama19,20, Yukinori Okada15,21,22,23,24, Takayuki Akimoto25, Hidetaka Kosako8, Akiko Takahashi18, Iichiro Shimomura5, Yasushi Sakata2 and Tamotsu Yoshimori1,3,4,12*(*責任著者)
所属:
1. 大阪大学 大学院医学系研究科 遺伝学
2. 大阪大学 大学院医学系研究科 循環器内科学
3. 大阪大学 大学院医学系研究科 保健学専攻
4. 大阪大学 大学院生命機能研究科 細胞内膜動態研究室
5. 大阪大学 大学院医学系研究科 内分泌・代謝内科学
6. 興和株式会社 東京創薬研究所
7. Division of Endocrinology, Diabetes and Metabolism, Beth Israel Deaconess Medical Center and Harvard Medical School
8. 徳島大学 先端酵素学研究所藤井節郎記念医科学センター 細胞情報学分野
9. 大阪大学 高等共創研究院
10. 奈良県立医科大学 生化学講座
11. 大阪大学 微生物病研究所
12. 大阪大学 先導的学際研究機構 生命医科学融合フロンティア研究部門
13. 早稲田大学 スポーツ科学学術院
14. 産業技術総合研究所 バイオメディカル研究部門
15. 大阪大学 大学院医学系研究科 遺伝統計学
16. 大阪大学 大学院医学系研究科 呼吸器・免疫内科学
17. 日本たばこ産業株式会社 医薬総合研究所 横浜リサーチセンター
18. 公益財団法人がん研究会 がん研究所 細胞老化研究部
19. 金沢大学 医学系 免疫学
20. 金沢大学 ナノ生命科学研究所
21. 東京大学 大学院医学系研究科 遺伝情報学
22. 理化学研究所 生命医科学研究センター システム遺伝学チーム
23. 大阪大学 免疫学フロンティア研究センター(IFReC)免役統計学
24. 大阪大学 ヒューマン・メタバース疾患研究拠点
25. 早稲田大学 スポーツ科学学術院 筋生物学研究室
DOI:https://doi.org/10.1038/s41556-024-01481-0
本研究は、日本医療研究開発機構(AMED)「老化メカニズムの解明・制御プロジェクト」における研究課題「オートファジーによる寿命延長機構」(研究代表者:吉森保)「JP21gm5010001」、科学技術振興機構(JST)戦略的創造研究推進事業 CREST研究領域「細胞外微粒子に起因する生命現象の解明とその制御に向けた基盤技術の創出」における研究課題「オートファジーによる細胞外微粒子応答と形成」(研究代表者:吉森保)「JPMJCR17H6」、日本学術振興会(JSPS)科研費 基盤研究S(研究代表者:吉森保)「22H04982」、AMED革新的先端研究開発支援事業(PRIME)「全ライフコースを対象とした個体の機能低下機構の解明」における研究課題「生殖腺によるオートファジー活性化を介した寿命制御機構の解明」(研究代表者:中村修平)「20gm6110003」、基盤C「オートファジー抑制因子Rubiconとその阻害剤の機能発現機構の解明」(研究代表者:上西達也)「20K05839」、日本学術振興会特別研究員奨励費「Rubiconによる新規エクソソーム産生制御機構の解明」(研究代表者:栁川恭佑)「22J12444」の一環として行われました。
参考URL
大阪大学 大学院医学系研究科 保健学専攻/遺伝学/生命機能研究科 細胞内膜動態学
http://www.fbs.osaka-u.ac.jp/labs/yoshimori/jp/
用語説明
- エクソソーム
エンドソームに由来する直径約50-150nmの細胞外小胞で、膜表面やその内部に蛋白質や核酸を内包する。内容物を受け手のレシピエント細胞へ輸送することで細胞間のコミュニケーションに役立っている。幹細胞や若い個体から得られたエクソソームは若返り効果を持つことが報告されている。
- オートファジー
酵母からヒトまで保存された細胞内の分解系で、オートファジー因子によって階層的に制御されている。二重膜構造体のオートファゴソームが細胞内のタンパク質や構造体を囲い込み、リソソーム(消化酵素をもつ細胞小器官)と融合することで内容物を分解・除去する。栄養源確保、代謝回転、疾患制御など幅広い生理的作用に重要であることがわかっている。
- 細胞老化
細胞が不可逆的に増殖を停止し、機能的に変化する現象のこと。細胞老化は、細胞がストレスや損傷(DNA損傷、酸化ストレスなど)にさらされてことにより引き起こされる防御的なメカニズムと考えられている。老化した細胞は炎症性サイトカインや成長因子などを分泌することで、周囲の環境に影響を及ぼす。細胞老化と個体老化は別の現象だが、老化細胞の増加は個体老化を促進するので、老化細胞を除去するセノリシスと呼ばれる抗老化法が注目されている。
- マイクロRNA
20〜25塩基ほどの短い1本鎖RNAで、現在ヒトで約2000 種類確認されている。タンパク質はコードしていないが、相補的配列を持つメッセンジャーRNAに結合し、その遺伝子発現の抑制に働く。
- 共免疫沈降質量分析法
タンパク質間の相互作用を解析する技術のひとつ。特定のタンパク質を抗体で捕捉し、そのタンパク質に結合している他のタンパク質を分離したのちに、質量分析を用いて分離されたタンパク質を同定する。
- ホスホイノシチド3-リン酸
細胞膜やエンドソーム膜に存在するリン脂質の一種で、細胞内シグナル伝達や膜輸送などの多くの細胞機能に関与する。
- ESCRT因子
Endosomal Sorting Complex Required for Transport
エンドソーム膜を内部に陥入させて内膜小胞を形成するタンパク質複合体。また、タンパク質の輸送、ウイルスの出芽、細胞質分裂時の細胞膜の分離、オートファジーの完了など、多様な膜動態のプロセスで重要な役割を果たす。
