クローン病を悪化させる因子を発見
腸内細菌が作りだすリゾホスファチジルセリンとその受容体を同定
研究成果のポイント
- クローン病患者の腸管内ではリゾリン脂質の一種であるリゾホスファチジルセリン (LysoPS)が増加する
- クローン病患者の腸管ではLysoPSを産生する酵素ホスホリパーゼAをコードする遺伝子を持つ大腸菌(Escherichia (E). coli)が増加する
- LysoPSは受容体P2Y10を介して獲得免疫細胞であるTh1細胞を活性化し、腸管炎症を重症化させる
- 「LysoPS-P2Y10受容体シグナルの制御」がクローン病の治療につながることが期待される
概要
クローン病(指定難病96)は、大腸・小腸の粘膜に慢性の炎症・潰瘍を起こす原因不明の疾患で、世界的に増加の一途をたどっています。大阪大学の飯島英樹特任准教授(大学院医学系研究科)、大竹由利子医師(大学院医学系研究科)、竹原徹郎教授(大学院医学系研究科)、香山尚子准教授(高等共創研究院/大学院医学系研究科)、竹田潔教授(大学院医学系研究科/免疫学フロンティア研究センター)らのグループは、腸内細菌叢の乱れにより増加するリゾリン脂質の一種LysoPSが病原性Th1細胞を活性化することでクローン病を悪化させることを明らかにしました(概念図)。
これまでに、クローン病患者における腸内細菌叢の変化や腸管内脂質分子の組成変化が報告されていました。しかし、「脂質分子の組成変化に腸内細菌が関与しているか?」また「クローン病で増加する脂質分子が寛解・増悪に関与するか?」は明らかになっていませんでした。
今回、研究グループは、以下を明らかにしました。
(1) 健常者に比べクローン病患者の便および血漿において、リゾリン脂質の一種であるLysoPSが増加すること
(2) クローン病患者ではホスファチジルセリンをLysoPSに変換する酵素ホスホリパーゼAをコードする遺伝子ECSF_3660を有するE. coliが増加していること
(3) クローン病患者の便を移植したマウスでは腸管内のLysoPSの濃度が上昇すること
(4) 野生型マウスの脾臓naive CD4+ T細胞を移入してクローン病様の大腸炎を発症させたRag2-/-マウスにLysoPSを投与すると、腸管内でTh1細胞が増加し、腸炎が重症化すること
(5) LysoPSはTh1細胞における解糖系を促進し、炎症性サイトカインであるIFN-g産生および細胞増殖を亢進させること
(6) LysoPSの受容体であるP2Y10の遺伝子を欠損させたnaive CD4+ T細胞を移入したRag2-/-マウスでは、LysoPS依存的な大腸炎の重症化が起こらないこと
以上より、「LysoPS-P2Y10受容体シグナルの制御法」「E. coli除去法」「E. coli由来ホスホリパーゼAの失活法」の確立がクローン病の治療法開発につながることが期待されます。
本研究成果は、2022年5月25日午前3時(日本時間)に米国の学術誌 Journal of Experimental Medicine (JEM) のオンライン版で公開されました。
本研究成果の概念図
腸内細菌由来の因子LysoPSが受容体P2Y10を介してTh1細胞を活性化してクローン病の増悪に関わることを示した。
研究の背景
大腸や小腸では、腸内細菌が生息する場(管腔)と免疫細胞が存在する場(粘膜固有層)は、上皮細胞が形成するバリアによって隔てられています。ヒトの生体内には、30-40兆個のヒト細胞に加え40兆個の腸内細菌が存在します。腸内細菌の生命活動の過程で生じる代謝産物(アデノシン三リン酸、 短鎖脂肪酸、ビタミン、神経伝達物質など)や構成成分(リポポリサッカライド、ポリサッカライドAなど)は、ヒトの免疫系・神経系・上皮バリアの発達に深く関与しています。そのため、腸内細菌叢の乱れは、免疫系や神経系の疾患発症や増悪につながります。炎症性腸疾患のひとつであるクローン病は、口から肛門までの全消化管において炎症性病変が生じうる慢性疾患であり、本邦をはじめ世界的に患者数が増加しています。クローン病の真の発症原因は分かっていませんが、腸内細菌叢の乱れ、獲得免疫細胞であるIFN-γを産生するTh1細胞やIL-17を産生するTh17細胞の活性異常などが病態形成に深く関わることが示唆されています。しかし、クローン病において獲得免疫細胞の異常な活性化を誘導する腸内細菌関連因子およびそのメカニズムの詳細については、未解明な点が多いのが現状です。
生体内には、タンパク質の数を超える種類の脂質分子が存在しており、生体内における様々な反応を司っていることが示唆されています。ヒトの細胞および腸内細菌の細胞膜は多様な脂質により構成されています。ヒトと腸内細菌はともに脂質を分解・合成する機能を持っており、一部の病原性細菌は脂質を分解する酵素を産生して、細胞膜を壊すことでヒト細胞内に侵入することが知られています。近年、脂質解析技術の進展により、炎症性腸疾患患者では、腸内細菌叢の変化に加え、血漿や便で一部の脂質分子が増加することが明らかになりました。しかし、多くの脂質分子については、「腸管内でどのようにして作り出されているのか?」また「疾患の発症・寛解・増悪にかかわっているのか?」は明らかになっていません。
研究内容の詳細
研究グループは、健常者と比べクローン病患者の便(腸管内の状況を反映する)において増加する15種類の脂質分子を同定しました(図1)。その中で、18:0 LysoPSと18:1 LysoPSのみがクローン病患者の血漿中においても増加していることを見出しました。
健常者とクローン病患者の便を用いてショットガン・シークエンシングを行った結果、クローン病患者の腸内にはLysoPSの産生に関わるホスホリパーゼAをコードする遺伝子ECSF_3660を持つE. coliが増えていることが明らかになりました。クローン病型腸内細菌叢を有するマウス(クローン病患者の便を経口投与したマウス)の腸管内では、健常者型腸内細菌叢を有するマウスに比べ、ECSF_3660を持つE. coliが多いこと、便中の18:0 LysoPSおよび18:1 LysoPS の濃度が高くなっていることが示されました。
LysoPSの腸管炎症への作用を明らかにするためRag2-/-マウスに野生型マウスの脾臓naive CD4+ T細胞を移入してクローン病に似た大腸炎を発症させたマウスに18:1 LysoPSを投与した結果、IFN-γ+ CD4+ T細胞やIFN-γ+ IL-17+ CD4+ T細胞の増加を伴う大腸炎の重症化が起こることが示されました。
Th1細胞培養中に18:1 LysoPSを添加するとIFN-γの産生と細胞増殖が促進することが明らかとなりました。さらに、網羅的な遺伝子発現解析を行った結果、Th1細胞では18:1 LysoPS刺激により細胞内代謝経路の一つである解糖系にかかわる遺伝子の発現が亢進していることが示されました。そこで、便中の18:1 LysoPSの濃度が低い・中程度・高いクローン病患者の末梢血中のCD4+ T細胞を用いて解糖系の活性化度合を示すECAR(細胞外酸性化速度)の値を測定しました。便中のLysoPS濃度に比例してECARの値が高くなることが示されました(図2)。また、マウスおよびヒトのTh1細胞を18:1 LysoPSで刺激する際に解糖系の阻害剤2-デオキシグルコースを添加すると18:1 LysoPS依存的なIFN-γ産生亢進が起こりませんでした。
LysoPSの受容体の一つであるP2Y10受容体がTh1細胞に高発現することが示されたため、P2Y10受容体を持たない(P2y10-/y P2y10b-/y)マウスもしくは野生型マウスの脾臓naive CD4+ T細胞を移入して大腸炎を発症させたRag2-/-マウスに18:1 LysoPSを腹腔内投与しました(図3)。野生型マウス由来の細胞を移入したRag2-/-マウスでは18:1 LysoPS投与後、大腸粘膜固有層内のTh1細胞の増加および大腸炎の重症化が示されました。しかし、P2Y10受容体を持たない細胞を移入したRag2-/-マウスでは18:1 LysoPS投与をしてもTh1細胞の数および腸炎の症状に変化はありませんでした。
これらの結果から、クローン病患者の腸管内において腸内細菌叢の乱れにより増加するリゾリン脂質LysoPSは、P2Y10受容体を介して解糖系を活性化することにより、過剰なTh1応答を誘導することで腸炎を悪化させることが明らかとなりました(概念図)。
図1. クローン病で増加する腸管内脂質分子
測定した脂質分子529種のなかで健常者に比べクローン病患者の便で増加していた脂質分子15種
図2. LysoPSによる解糖系の活性化
A: 3名の(CD12, CD13, CD08)の便中の18:1 LysoPS濃度
B: Aで示したクローン病患者の末梢血から回収したCD4+CD25-CD45RO+メモリーT細胞を用いて解糖系の活性化指標であるECAR(細胞外酸性化速度)を測定
図3. LysoPS-PSY10受容体シグナルによるT細胞依存的大腸炎の増悪
野生型マウスもしくはP2ry10-/yP2ry10b-/yマウスの脾臓CD4+CD25-CD44+CD62L+ナイーブT細胞をRag2-/-マウスに移入し、20, 21, 22日目に18:1LysoPS(2.5mg/kg体重)を投与した。
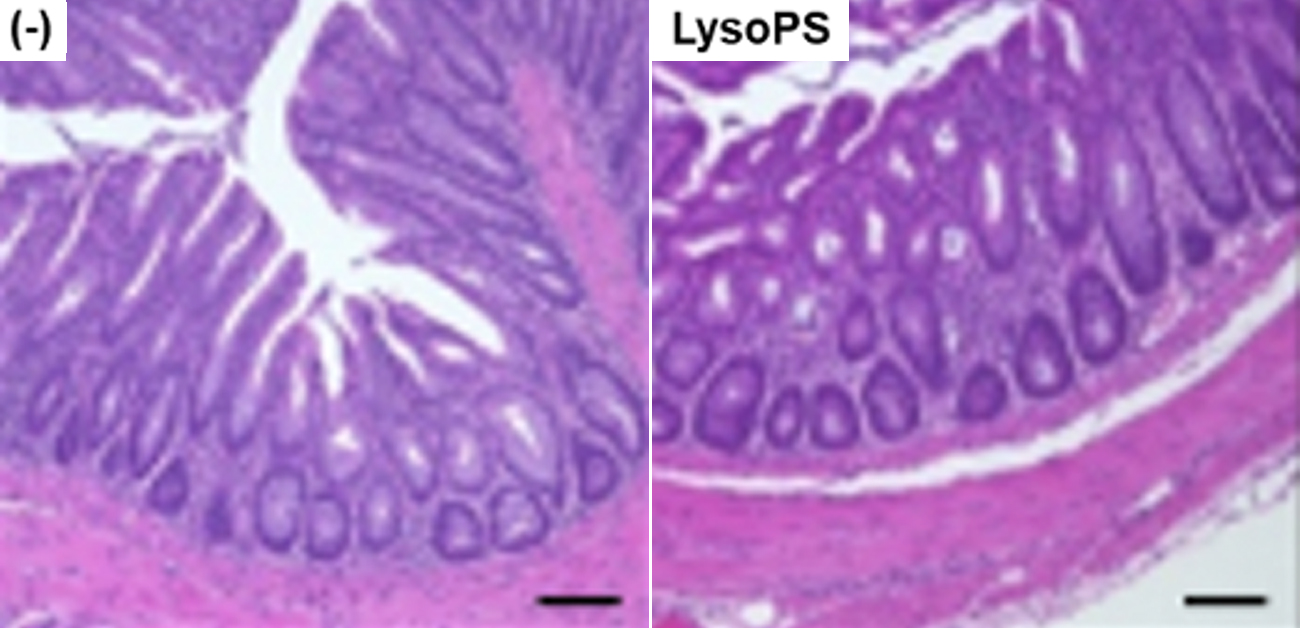
A: 最終投与24時間後の大腸組織のH&E染色像(左)と腸炎の組織学的評価
B: 最終投与24時間後の大腸粘膜固有層内のIFN-γ+CD4+T(Th1)細胞の数。
本研究成果が社会に与える影響(本研究成果の意義)
クローン病患者の数は、世界的に増加の一途をたどっており、症状に合わせた多様な治療法の開発が望まれています。本研究により、クローン病患者では、腸内細菌の乱れによりLysoPSが増加すること、マウス腸管においてLysoPSがTh1細胞の異常な活性化を誘導し、腸炎を重症化させることが明らかになりました。クローン病患者では、腸管粘膜におけるTh1細胞の増加が病態に深く関与することが報告されており、「LysoPS-P2Y10受容体シグナル経路」「E. coli由来ホスホリパーゼA」などがクローン病の創薬標的となることが期待されます。
特記事項
本研究成果は、2022年5月25日午前3時(日本時間)にJournal of Experimental Medicineのオンライン版で公開されました。
【タイトル】“Lysophosphatidylserines derived from microbiota in Crohn’s disease elicit pathological Th1 response”
【著者】Yuriko Otake-Kasamoto#, Hisako Kayama#, Toshihiro Kishikawa, Shinichiro Shinzaki, Taku Tashiro, Takahiro Amano, Mizuki Tani, Takeo Yoshihara, Bo Li, Haruka Tani, Li Liu, Akio Hayashi, Daisuke Okuzaki, Daisuke Motooka, Shota Nakamura, Yukinori Okada, Hideki Iijima*, Kiyoshi Takeda*, and Tetsuo Takehara (#; equal contribution, *; equal correspondence)
日本医療研究開発機構(AMED)革新的先端研究開発支援事業AMED-CREST:腸内微生物叢の宿主共生と宿主相互作用機構の解明、2017年度日本学術振興会科学研究費助成事業基盤研究B、日本医療研究開発機構革新的先端研究開発支援事業PRIME:間葉系ストローマ細胞と免疫細胞の相互作用による腸管恒常性維持機構に関する研究開発より支援を受けて実施されました。
用語説明
- クローン病
厚生労働省により難病に指定されている疾患。消化管全体に炎症病変が生じ得る慢性疾患であり発症原因は解明されていない。
- リゾリン脂質
細胞膜の主要構成成分であるリン脂質が有する2本のアシル基のうちいずれか1本がとれたもの。前駆体であるリン脂質に比べ水溶性が高い。受容体や膜間移動を介して脂質メディエーターとして作用する。
- リゾホスファチジルセリン
リン脂質ホスファチジルセリンが有する2本のアシル基のうちいずれか1本がホスホリパーゼAにより切断されることにより産生されるリゾリン脂質。ヒトではP2Y10, GPR34, GPR174が受容体として報告されている。
- ホスホリパーゼA
ホスファチジルセリンを含むグリセロリン脂質のグリセロール骨格に結合した2本のアシル基の一方を加水分解する酵素。sn-1アシル基を切断する酵素をホスホリパーゼA1、sn-2アシル基を切断してアラキドン酸を生成する酵素をホスホリパーゼA2と称する。
- Escherichia coli(E. coli)
通性嫌気性のグラム陰性桿菌。ヒト腸内常在細菌の一つ。大部分の菌株は無害であるが、一部の菌株は病原性を持つ。
- Th1細胞
炎症性サイトカインIFN-γやTNF-αを産生する獲得免疫細胞CD4+ Tリンパ球の一種。自然免疫細胞であるマクロファージや樹状細胞を活性化する。細菌やウイルスを排除する生体防御に必須の細胞であるが、自己免疫疾患や炎症性疾患の発症や重症化にも関わる。
- Rag2-/-マウス
獲得免疫細胞であるT細胞とB細胞の受容体遺伝子の再構成に必要な酵素をコードする遺伝子Rag2を欠損させたマウス。B細胞とT細胞が分化しない。
- 解糖系
細胞内に取り込んだグルコース(糖)をピルビン酸に変換する経路。1分子のグルコースから2分子のアデノシン三リン酸が産生され、中間代謝産物である核酸、アミノ酸、脂肪酸などは細胞構成成分の合成に利用される。
- ョットガン・シークエンシング
便中に含まれる全微生物(細菌・ウイルス・真菌・古細菌)のゲノム情報を網羅的に解析する技術。系統解析と機能(遺伝子・パスウェイ)解析を同時に行える。
