染色体分配の「担い手」を原子レベルで構造決定
抗がん剤のデザインに期待
研究成果のポイント
- 染色体分配を担う主要な複合体構造 (動原体構造)についてクライオ電子顕微鏡を用いて原子レベルで解明
- 特定のタンパク質のリン酸化により動原体構造が強固になることを発見
- 細胞分裂期に観察される動原体構成の変化を構造から説明
- 染色体分配不全が原因で生じるがんに対する抗がん剤デザインに期待
概要
大阪大学大学院生命機能研究科の有吉眞理子 特任助教(常勤)・牧野文信 招へい准教授・深川竜郎教授らの研究グループは、同研究科の難波啓一特任教授、東京大学 胡桃坂仁志教授らと共同で、生命の設計図である染色体の分配 (図1) に必須な動原体構造の一部を原子レベルで明らかにしました。染色体の分配不全は、細胞のがん化を引き起こすことが知られており、今回の原子構造をベースにした抗がん剤の開発が期待されます。
今回、本研究グループは、ニワトリおよびヒトの動原体タンパク質を使って、動原体の構成基盤であるCENP-A複合体(タンパク質-DNA複合体)と動原体タンパク質の一つであるCENP-Cとの結合を解析しました。
CENP-A複合体とCENP-Cの結合にはCENP-Cのリン酸化の関与が予測されていたため、これらを細胞外で復元・精製し、その構造を凍結(クライオ)単粒子電子顕微鏡観察法で観察しました。その結果、CENP-Cのリン酸化によってCENP-A複合体とCENP-Cの結合を安定化させる機構を原子レベルで明らかにしました (図2)。
さらに、これまでCENP-Cに加えてCENP-A複合体に結合すると考えられていたCENP-Nは、リン酸化されたCENP-CとCENP-A複合体の安定な結合によってCENP-A への結合が阻害されることも明らかになりました(図3)。CENP-Cのリン酸化は、細胞分裂期に特異的におこるので、CENP-Nが細胞
分裂期に排除されるしくみを解明したことになります。
染色体の分配不全は、がんや様々な遺伝病の原因となることがわかっています。染色体の分配メカニズムを原子レベルの構造で解明することは、抗がん剤のデザインに貢献することが期待されます。
本研究成果は、英国科学誌「EMBO Journal」に、1月19日(火)午後8時(日本時間)に公開されました。
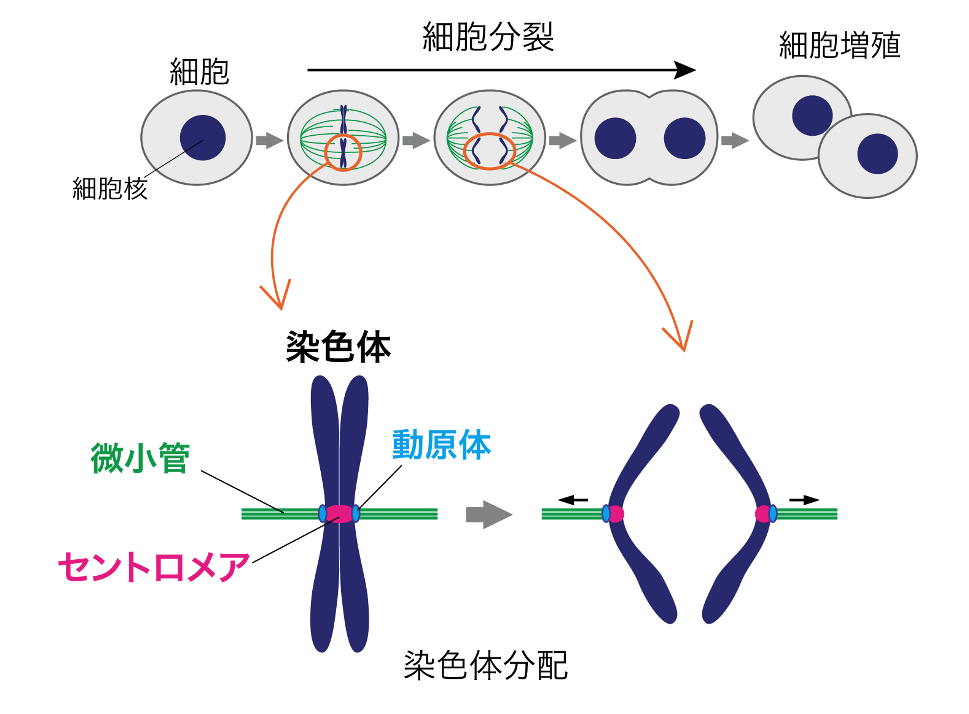
図1 染色体分配の模式図
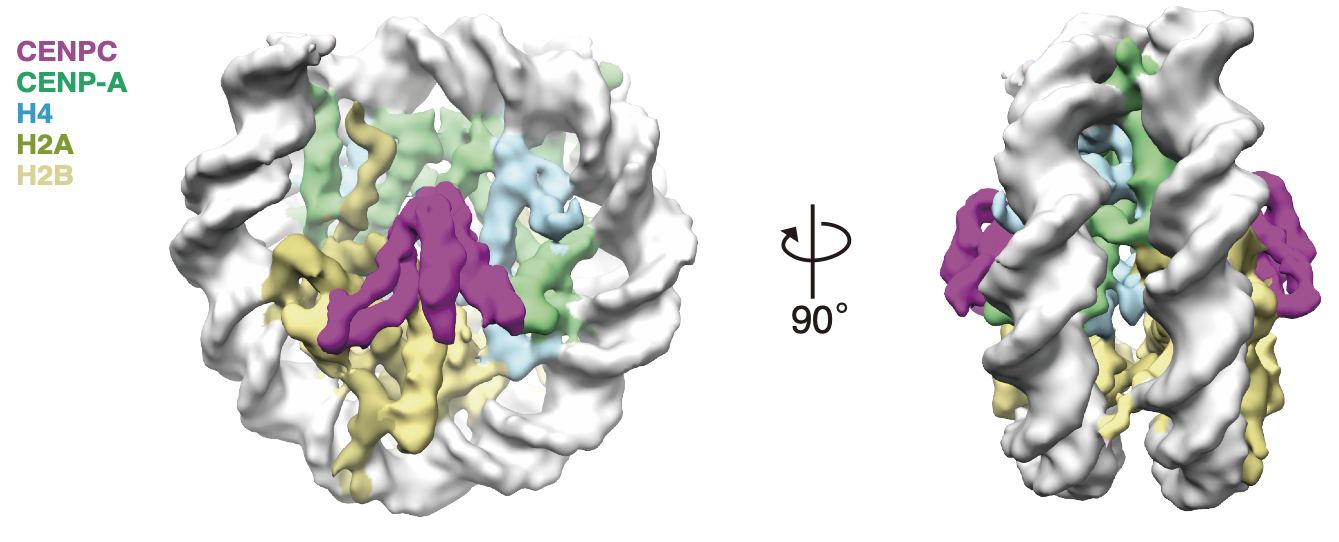
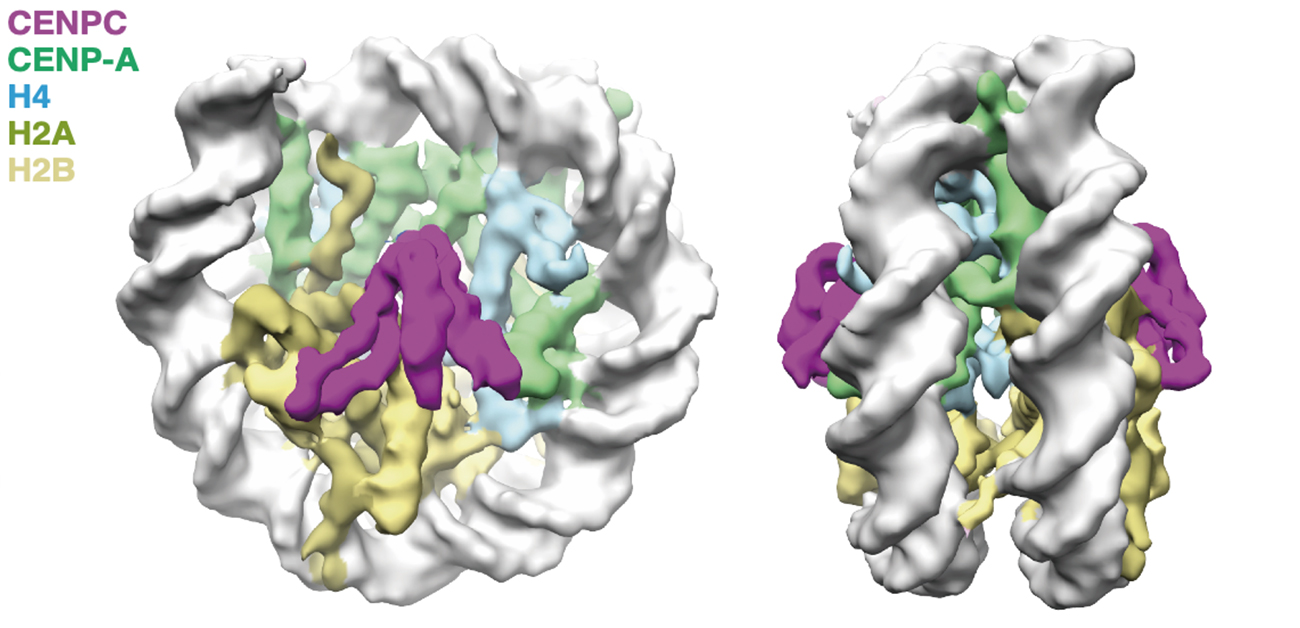
図2 CENP-A複合体とCENP-Cの構造
研究の背景
生物のすべての遺伝情報(ゲノム)は、染色体と呼ばれる構造体に包まれ、次世代の細胞に伝達されていきます (図1)。そのため、染色体の正確な伝達は、生命を維持する上で必須ですが、染色体の伝達に問題がおこると、染色体構造に異常が生じます。これらの染色体異常は、がんやダウン症を始め、多くの病気の原因になることが知られています。したがって、染色体が正確に次世代の細胞へ伝達されるしくみを解明することは、生命を維持するための基本原理の理解につながります。それと同時に、染色体異常が原因で起こる病気 (がんやダウン症など) の発症機構の解明や抗がん剤の開発にも貢献します。
染色体の伝達は、細胞の両極から伸びた紡錘体微小管 (紡錘糸)が染色体上のセントロメア(図1)と呼ばれる領域に形成された動原体構造を捉え、娘細胞と呼ばれる次世代の細胞へ染色体を分けることによって行われます。したがって、染色体が正確に娘細胞へ伝達されるしくみを知るためには、動原体構造が形成されるしくみを詳細に理解しなければなりません。
これまで、動原体構造の形成にはCENP-Aと呼ばれるセントロメアに特異的なDNA結合タンパク質が中心となり、複数のタンパク質がCENP-A複合体を認識することが重要だと考えられていました。しかしながら、どのようなメカニズムでそのようなタンパク質が、CENP-A複合体と結合するのかは、不明でした。研究グループは、そのメカニズムを解明することを目指して研究を行ってきました。
本研究成果
本研究グループは、CENP-A複合体、CENP-A結合タンパク質であるCENP-CおよびCENP-Nを大腸菌で発現させ精製しました。また、CENP-Cはリン酸化によってCENP-Aへの結合が増加することを本グループは明らかにしていたので (Watanabe et al., J. Cell Biol., 2019、https://resou.osaka-u.ac.jp/ja/research/2019/20191031_2 )、CENP-Cはリン酸化酵素でリン酸化させました。 その上で、これらのタンパク質を混合・結合させ動原体構造を再現しました。そしてこの複合体構造を凍結 (クライオ) 単粒子電子顕微鏡観察法で解析しました。
その結果、CENP-CとCENP-A複合体の原子レベルでの構造が観察できました(図2)。構造を詳細に解析するとCENP-Cのリン酸化残基がCENP-CとCENP-A結合領域を安定化させていることが判明しました。
また、興味深いことにリン酸化したCENP-Cの存在下では、CENP-NはCENP-Aと結合できないことも明らかになりました。
CENP-Cのリン酸化は、細胞分裂期特異的におこるので、CENP-Nが、細胞分裂期に
特異的にCENP-A複合体から排除されるしくみを明らかにできました (図3)。動原体構成の変化のしくみを原子構造から説明できる画期的な成果といえます。
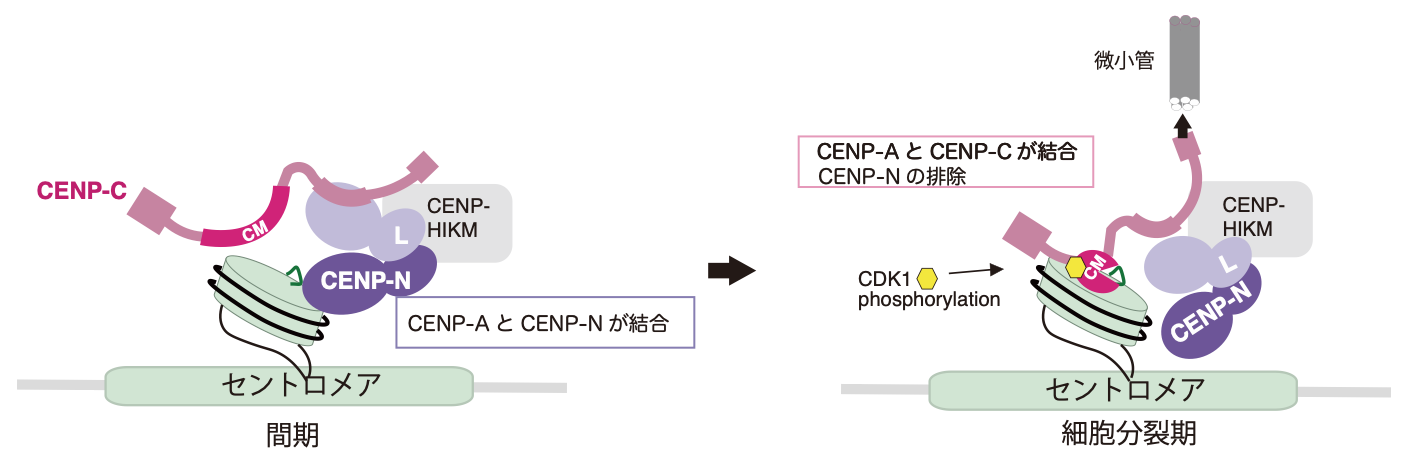
図3 動原体の構成変化のモデル図
本研究成果が社会に与える影響(本研究成果の意義)
本研究成果により、動原体の構造が原子レベルで明らかになりました。動原体の働きをコントロールすることが、抗がん剤の開発には重要と考えられていますが、原子レベルの構造解析により、ドラッグデザインに一歩踏み込んだ貢献ができると考えられます。
特記事項
本研究成果は、英国科学誌「EMBO Journal」に、1月19日(火)午後8時(日本時間)に公開されました。
タイトル:“Cryo-EM structure of the CENP-A nucleosome in complex with phosphorylated CENP-C”
著者名:Mariko Ariyoshi (大阪大学大学院生命機能研究科), Fumiaki Makino (大阪大学大学院生命機能研究科), Reito Watanabe (大阪大学大学院生命機能研究科), Reiko Nakagawa (理化学研究所BDR), Takayuki Kato (大阪大学蛋白質研究所), Keiichi Namba (大阪大学大学院生命機能研究科) Yasuhiro Arimura (東京大学定量生命科学研究所), Risa Fujita (東京大学定量生命科学研究所), Hitoshi Kurumizaka (東京大学定量生命科学研究所), Ei-ichi Okumura (東京工業大学), Masatoshi Hara (大阪大学大学院生命機能研究科) and Tatsuo Fukagawa* (大阪大学大学院生命機能研究科)
*責任著者
以下の研究費の支援によって行われました。
- 科学研究費補助金 基盤研究(S)「染色体分配に必須なセントロメアの形成機構の解明」(研究代表:深川竜郎(大阪大学大学院生命機能研究科教授))
- 科学研究費補助金 新学術領域研究「非ゲノム情報によって制御されるセントロメアの維持・形成機構」(研究代表:深川竜郎(大阪大学大学院生命機能研究科教授))
参考URL; 直近5年間で報告した染色体に関する研究成果など
- 世界初!!クリプトコッカス独自の細胞分裂機構を解明
(https://resou.osaka-u.ac.jp/ja/research/2021/20210108_1) - 細胞分裂に働く因子の新知見。鍵を握るヒト特有のアミノ酸
(https://resou.osaka-u.ac.jp/ja/research/2020/20201118_1) - 細胞分裂時に染色体の分配を制御する鍵となるしくみを解明
(https://resou.osaka-u.ac.jp/ja/research/2019/20191031_2) - 染色体の分配装置が形成される仕組みを解明
(https://resou.osaka-u.ac.jp/ja/research/2017/20170725_1) - 遺伝子が次世代へ伝わるメカニズムを解明
(https://resou.osaka-u.ac.jp/ja/research/2016/20161104_2) - 深川竜郎教授
http://www.dma.jim.osaka-u.ac.jp/view?l=ja&u=10002507&k=%E6%B7%B1%E5%B7%9D%E7%AB%9C%E9%83%8E&kc=1&sm=keyword&sl=ja&sp=1
用語説明
- 染色体分配
細胞には、遺伝情報を含んだ染色体が複数存在する。これら染色体は、細胞が分裂して増える前に2つにコピーされ、細胞分裂にともない次世代の細胞に分けられなければならない。このコピーされた染色体を子孫の細胞へ均等に受け渡すことを染色体分配という。(図1)
- 動原体
染色体上に形成される巨大なタンパク質複合体。細胞分裂が起こるとき、染色体を引っ張る糸(微小管)と結合し、染色体と微小管との結合を仲介することで染色体分配の過程で重要な働きをする。
- タンパク質のリン酸化
タンパク質のリン酸化は、生物に存在する重要な調節機構であり、キナーゼと呼ばれる酵素によって行われる。リン酸化はタンパク質のセリン、スレオニン、そしてチロシンの残基に起こる。リン酸化の調節の例として、Cdk1キナーゼによって細胞周期の進行が制御される例は有名である。
- CENP-A 複合体
動原体構築の土台になるタンパク質―DNA複合体。CENP-Aというヒストンタンパク質の一種が、他のヒストンと複合体を形成し、DNAと結合して動原体が構築されるゲノム領域に存在する。CENP-A 複合体に他のタンパク質が結合して動原体は形成される。
- CENP-C
CENP-A 複合体に結合する動原体タンパク質の一種。染色体分配に必須の働きを行う構造タンパク質として機能していると考えられている。
- 凍結 (クライオ) 単粒子電子顕微鏡観察法
単粒子解析クライオ電子顕微鏡 (クライオEM)は、構造生物学者が原子分解能で構造を解明するため用いる手法で、近年急速に普及している。この手法は、従来構造解析に使用されていたX線結晶構造解析法を補完するもので、結晶試料がなくても構造上の詳細を明らかにできる。ガラス質(非晶質)の氷で凍結水和させた試料を観察することにより、試料の超微細構造、緩衝液、および配位子分布が元の状態のまま保持される。電子顕微鏡に付属するカメラの検出方法の進展と共に発展した。この技術には2017年のノーベル化学賞が与えられている。
- CENP-N
CENP-A 複合体に結合する動原体タンパク質の一種。上述のCENP-Cとは、配列は全く異なる。
- セントロメア
染色体のほぼ中央にあるくびれた部分。細胞分裂の際、染色体分配に重要な染色体領域であり、紡錘糸が結合する動原体構造が形成される領域である。
