染色体分配の「担い手」動原体の形成メカニズムを発見
長年見過ごされてきたCENP-Cの真の機能の解明
研究成果のポイント
- 染色体の分配に必要な動原体 (キネトコア)2 構造がつくられる分子メカニズムを解明
- これまでの構造解析では見過ごされていた動原体タンパク質 CENP-Cの真の機能を発見
- CENP-Cの真の機能は、多量体化による自己集合であり、その機能をなくすと染色体が分配されないことを証明
- 染色体が正確に維持されるメカニズムの解明や、その破綻に起因する疾病の防止や治療法の開発にも期待
概要
大阪大学大学院生命機能研究科の原昌稔 助教、有吉眞理子 特任助教(常勤)、佐野智基 大学院生 (研究当時)、深川竜郎 教授らの研究グループは、染色体の分配に必須な構造体である動原体 (キネトコア) が作られる分子メカニズムを、タンパク質構造解析と細胞生物学的解析を組み合わせることで解明しました。
キネトコアは、複数のタンパク質によって作られる巨大な複合体であり、染色体上のセントロメアと呼ばれる領域に形成されます。キネトコアは細胞の分裂装置である紡錘体微小管と結合し、染色体が分配されるために必須なので、その「構造」や「つくられかた」を理解することが大変重要です。キネトコア構造は、近年のクライオ電子顕微鏡などの構造解析技術の発展により、その詳細は明らかになりつつあります。しかし、キネトコア構成因子のひとつであるCENP-Cというタンパク質は、キネトコアの形成の鍵をにぎると考えられていましたが、これまでの解析では、構造や機能がよくわかっておらず、それらは長年の謎でした。
今回、深川竜郎教授らの研究グループは、ヒトを含む脊椎動物のCENP-Cタンパク質が、自己で集まり、多量体化することを見出しました。さらに、この多量体化のメカニズムを明らかにし、CENP-Cを多量体化させないように細工をすると、キネトコアが形成されずに染色体が分配されないことを示しました。これは、長年見過ごされてきたCENP-Cの真の機能であり、キネトコアの形成メカニズムを理解できたと言えます。この発見は、染色体が正確に維持されるメカニズムの解明に繋がり、その破綻に起因する疾病の防止や治療法の開発への貢献も期待されます。
本研究成果は、2023年6月9日(金)午前1時(日本時間)に米国科学誌「Molecular Cell」に掲載されました。
研究の背景
わたしたちの体を作るための情報 (遺伝情報) は、細胞の中の染色体のなかに記されています。細胞が分裂して増殖するときに、遺伝情報を乗せた染色体は、複製された後に、新しいふたつの細胞へ正しく均等に分配されなければなりません (図1)。この染色体の均等な分配に失敗すると、遺伝情報にダメージが入り、細胞が死んでしまったり、多くの病気の原因となったりします。正確な染色体の分配を行わせるために重要な役割を担うのが、動原体 (キネトコア) です (図1)。キネトコアは、染色体の上のセントロメアという特殊なクロマチン領域に形成されるタンパク質複合体で、紡錘体微小管と結合し、染色体分配の足場としてはたらきます (図1)。そのため、キネトコア複合体がどのようにつくられ、機能するかを知ることは、「わたしたちの遺伝情報がいかにして正確に次世代へと伝わるのか?」という、生物学の根本的な問題を解明することにつながります。
キネトコアを構成するタンパク質群のなかで、CCANと呼ばれる複合体は、キネトコア構造の土台を構築すると考えられています。脊椎動物のCCANは、今回研究対象としたCENP-Cを含む16種類のタンパク質により形成されています。近年、そのCCANタンパク質複合体の構造が、クライオ電子顕微鏡によって解析されましたが、その構造中にCENP-Cの形がほんの一部分しか含まれていませんでした。いっぽうで、CENP-CはさまざまCCAN構成タンパク質と結合することが知られ、キネトコア形成のハブとも思われています。すなわち、CENP-Cタンパク質の構造や機能が、CCANを理解するために必要な“最後の謎”として残されていました。
そこで、深川竜郎教授らの研究グループは、「CENP-Cの真の機能は何か?」という長年の謎を解き明かすことを目指しました。それにより、キネトコアがどうやって形づくられるのかという生物学の重要な問題に答えることができます。
図1. 染色体分配とキネトコア
研究の内容
はじめに、CENP-Cタンパク質の機能を明らかにするために、遺伝子改変が容易なニワトリ培養細胞をモデル系として使用し、CENP-Cのどの部分が重要であるかを調べました。その結果、CENP-Cタンパク質の中央にある領域 (中央領域) と、右端のカルボキシ末端領域 (図2 CENP-Cの右端、C末領域) との二つの領域が、CENP-Cの機能に必須であることが明らかとなりました (図2)。
CENP-Cの中央領域は、他のCCANタンパク質との結合に必要であることがよく知られていますが、C末領域はCupinドメインとよばれる特徴的な領域を含んでいるのですが、その役割はほとんどわかっていませんでした。そこで、このC末領域の機能を明らかにするために、この領域を試験管内で純化してその立体構造をX線結晶構造解析により決定しました。
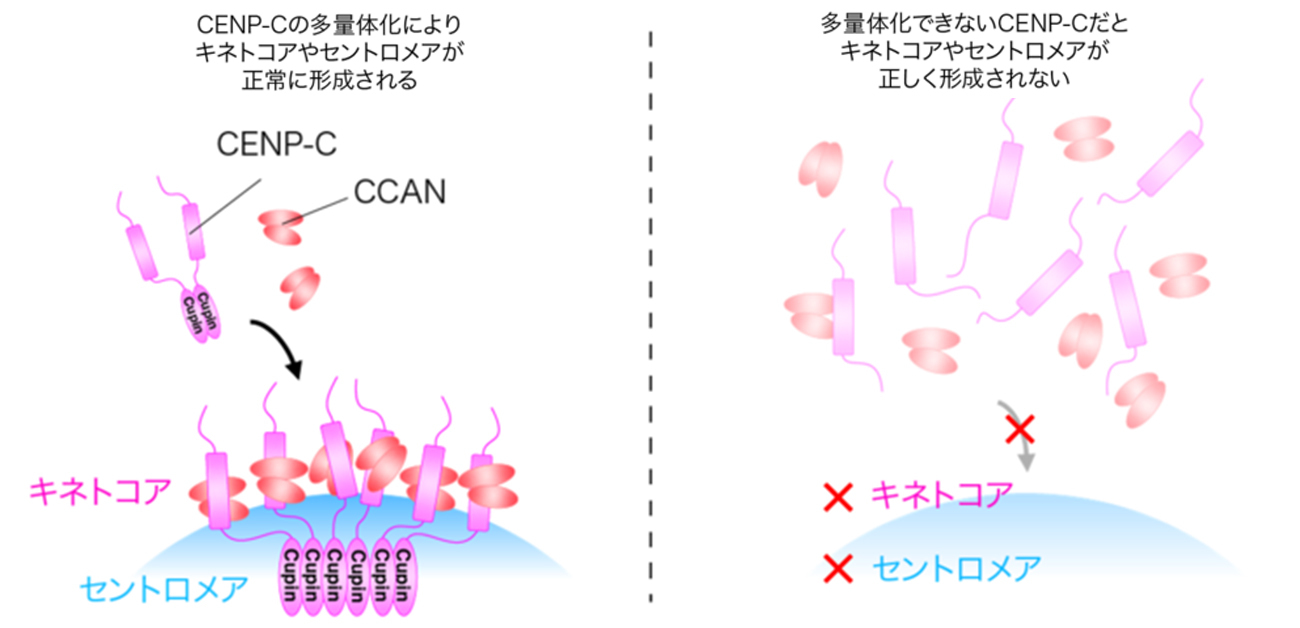
その結果、C末領域はCupinドメインを介した二量体構造を基本にして、それがさらに集まって多量体化することを見出しました (図2)。このCENP-Cの多量体化は、ニワトリCENP-Cだけでなく、ヒトCENP-Cでも同じように起きていました。
つぎに、CENP-Cの多量体化の重要性を調べるために、この多量体化が起きないように細工したCENP-Cを細胞内に発現させました。その結果、多量体化しないCENP-Cは正常に機能せず、キネトコアは正常に形成されませんでした。その結果、正確な染色体の分配は起きませんでした。以上のことから、CENP-Cの多量体化は、キネトコアをセントロメア上に正しくつくるために、重要であることが明らかとなりました (図2,3)。
さらに、CENP-Cの多量体化は、キネトコアの形だけでなく、セントロメア領域の特殊なクロマチン形成に必須であることを明らかにしました (図2,3)。
以上のことから、CENP-Cの真の機能は、「自身を集め、多量体化することで、セントロメア上に安定にキネトコア構築するとともに、セントロメアの特殊なクロマチン構造を形成すること」が明らかになりました。これらの結果は、キネトコア構造の理解のための長年の謎を解く、重要な成果と言えます。
図2. CENP-C Cupinドメインの多量体化とその機能
図3. Cupinドメインを介したCENP-C多量体化はキネトコア・セントロメア形成に必須である
本研究成果が社会に与える影響(本研究成果の意義)
本研究成果により、これまで謎であったCENP-Cの機能とその多量体化の重要性が明らかになりました。これにより、ヒトを含む脊椎動物のキネトコア複合体構造の正しい理解が可能になったと言えます。このようなキネトコア構造の実像を描けるようになることで、遺伝情報の正確性を維持するメカニズムの理解が可能となるだけなく、その破綻に起因する疾病の防止や治療への貢献も期待されます。
特記事項
本研究成果は、2023年6月9日(金)午前1時(日本時間)に米国科学誌「Molecular Cell」に掲載されました。
タイトル:“Centromere/kinetochore is assembled through CENP-C oligomerization”
著者名:Masatoshi Hara1*, Mariko Ariyoshi1, Tomoki Sano1, Ryu-Suke Nozawa2, Soya Shinkai3, Shuichi Onami3, Isabelle Jansen4, Toru Hirota2 and Tatsuo Fukagawa1* (*責任著者)
所属:
1. 大阪大学大学院生命機能研究科
2. がん研究会がん研究所実験病理部
3. 理化学研究所生命機能科学研究センター発生動態研究チーム
4. Abberior Instruments GmbH
DOI:https://doi.org/10.1016/j.molcel.2023.05.023
本研究は、公益財団法人がん研究会がん研究所実験病理部 広田亨部長、野澤竜介研究員、国立研究開発法人理化学研究所生命機能科学研究センター発生動態研究チーム 大浪修一チームリーダー、新海創也研究員、Abberior Instruments GmbH Isabelle Jansen博士の協力を得て行われました。
なお、本研究は、以下の研究費の支援によって行われました
・JST戦略的創造研究推進事業 CREST「動原体超分子複合体の構造ダイナミクス」(研究代表:深川竜郎)
・科学研究費補助金 基盤研究 (A)「セントロメア/動原体機能の包括的理解」(研究代表:深川竜郎)
・科学研究費補助金 新学術領域研究「非ゲノム情報によって制御されるセントロメアの維持・形成機構」(研究代表:深川竜郎)
・科学研究費補助金 学術変革領域研究「セントロメアモダリティの理解」(研究代表:深川竜郎)
・科学研究費補助金 基盤研究 (B)「セントロメアクロマチンの”コンパクトさ”を形作る機構とその意義」 (研究代表:原昌稔)
・武田科学振興財団 ライフサイエンス研究助成 (研究代表:原 昌稔)
参考URL
SDGsの目標
用語説明
- 染色体
染色体は、遺伝情報が記録されている構造体で、細胞に複数本存在する。これら染色体は、細胞が分裂して増える前に2つにコピーされ、細胞分裂にともない次世代の細胞に分けられなければならない。この過程を染色体分配と呼び、遺伝情報の継承に必須なイベントである。
- 動原体 (キネトコア)
染色体上のセントロメアと呼ばれる領域に形成される巨大なタンパク質複合体である。染色体分配が起こるときに、染色体を引っ張る糸(紡錘体微小管)と結合し、染色体と微小管との結合を仲介する。
- CENP-C
キネトコアを構成するタンパク質の一つで、今回の研究対象。下記CCANの構成因子の一つ。染色体分配には必須のタンパク質であり、キネトコア形成のハブとして予想されていたタンパク質。
- セントロメア
各染色体にひとつずつ存在するクロマチン領域 (以下に説明)で、キネトコア複合体を形成されるための足場として染色体分配に重要な働きをする。
- 紡錘体微小管
真核生物の細胞分裂で染色体を分配させるための骨格構造を紡錘体と呼び、その中に最も多く含まれる構成要素が微小管である。微小管はキネトコアと結合し、染色体分配を達成させる。
- クライオ電子顕微鏡
単粒子解析クライオ電子顕微鏡 (クライオEM)は、構造生物学者が原子分解能で構造を解明するため用いる手法で、近年急速に普及している。この手法は、従来構造解析に使用されていたX線結晶構造解析*9法を補完するもので、結晶試料がなくても構造上の詳細を明らかにできる。
- クロマチン
DNAとタンパク質が結合することで作られる複合体構造である。遺伝情報の担い手であるDNAは、このクロマチン構造により、コンパクトに染色体内に収納される。DNAに結合するタンパク質の種類や状態が違うと、異なるクロマチン構造が形成される。その構造の差異により、クロマチン領域の機能発現が調節される。
- CCAN
キネトコアを構成するタンパク質複合体のひとつで、Constitutive-Centromere-Associated Networkの略。恒常的にセントロメア上に局在するタンパク質複合体で、脊椎動物では16種類のタンパク質群から形成される。CCANはセントロメアクロマチンに直接結合し、キネトコア構造の土台を形成する。
- X線結晶構造解析
タンパク質の構造解析法の一つ。結晶化したタンパク質にX線を当て、多数の特定の方向に回折する性質を用いて、結晶の原子構造や分子構造を決定する解析手法。クライオEMと比べて、大量の試料を必要とするが、高い解像度が得られる。


