染色体の担い手「動原体」は 細胞周期で異なるタンパク質と結合していた
がんやダウン症など染色体不全から生じる疾患へのドラッグデザインに期待
お読みいただく前に
染色体分配の研究は、基礎科学的に重要な課題ですが、詳細メカニズムを解明し機能をコントロールすることで、がん細胞だけを特異的に死滅させる技術などへの応用や、がんの分子標的の開発が期待でき、近年注目を集めています。
研究成果のポイント
- 染色体分配を担う主要なタンパク質複合体 (動原体)の構造変化について凍結 (クライオ)電子顕微鏡を用いて原子レベルで解析
- 動原体のできるゲノム領域 (セントロメア)には、細胞周期に応じて異なるタンパク質が結合することを解明
- 細胞が分裂する時期以外の細胞周期:間期では、KNL2というタンパク質がセントロメアと結合し、細胞分裂期にはKNL2がセントロメアから離れ、CENP-Cという他のタンパク質と結合する構造変化を発見
- 間期でのセントロメアとKNL2の結合は、DNAの格納(折りたたみ)サポート役のタンパク質:ヒストンの一つ、CENP-Aの取り込みに関与することが明らかに
- 動原体異常に伴う染色体分配の不具合が原因で生じるがんをはじめとする疾患に対するドラッグ
概要
大阪大学大学院生命機能研究科の大学院生 江 泓慧 (こう おうけい) さん(博士課程)、有吉眞理子 特任助教(常勤)、深川竜郎教授らの研究グループは、凍結 (クライオ) 電子顕微鏡解析技術を活用し、生命の設計図である染色体の分配 (図1) に必須な動原体の構造変化を原子レベルで明らかにしました。また、この動原体におけるタンパク質複合体の構造変化が、生命維持に必須であることも明らかにしています。染色体の分配不全は、細胞のがん化をはじめとして多くの疾患を引き起こすことが知られており、今後、原子レベルでの構造情報をベースにしたドラッグデザインが期待されます。
染色体分配に必須である動原体は、セントロメアと呼ばれるゲノム領域に形成され、この領域のみに存在するCENP-Aと呼ばれる特異的なヒストン(DNAを格納する役割を担うサポーター)の存在が知られています。つまり、動原体タンパク質がCENP-Aヒストン複合体と結合することが動原体の形成には必須であり、深川グループは以前、ニワトリ細胞を用いた実験から、CENP-Cという動原体タンパク質が、細胞分裂期にCENP-Aヒストン複合体と結合することを見出し、その結合について原子レベルで構造解析しています (Ariyoshi et al., EMBO J., 2021、https://resou.osaka-u.ac.jp/ja/research/2021/20210119_1)。しかし、CENP-Cが、間期にもCENP-Aヒストン複合体と結合しているのかどうか、結合していない場合には、どのようなタンパク質と結合するのか判っていませんでした。
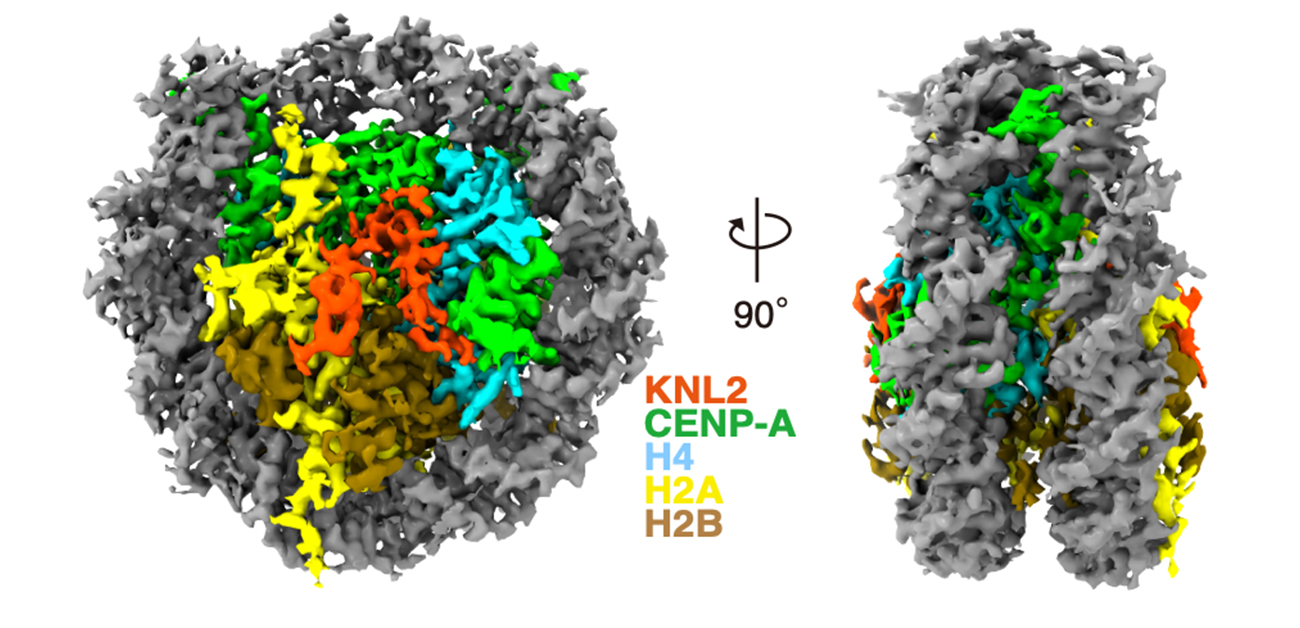
今回、深川教授らの研究グループは、CENP-Cに似た配列を持つKNL2と呼ばれるタンパク質がCENP-Cの代わりにニワトリ細胞の間期にCENP-Aヒストン複合体と結合していることを明らかにしました。さらに、試験管内でCENP-Aヒストン複合体とKNL2が結合した複合体を精製し、生体内でのそれらの結合様式・立体構造の再現を試みました。さらに、精製したタンパク質複合体をクライオ電子顕微鏡で解析し、その構造の詳細を原子レベルで明らかにしました (図2)。
その結果、CENP-Cが結合する場所にKNL2が結合していることを明らかにしました。また、分裂期になり、CENP-Cがリン酸化を受けると、KNL2をCENP-Aヒストン複合体から押し出してCENP-C自身がCENP-Aヒストン複合体と結合するという構造変化を示しました (図3)。
KNL2が、セントロメアにつきっぱなしになると染色体分配異常がおこることから、この構造変化によって得られる機能こそが、染色体分配に必須であると言えます。さらに、間期でのKNL2とCENP-Aヒストン複合体との結合が、新しいCENP-Aの取り込みにも重要であることも明らかにしました (図4)。
今回の実験では、1) 間期にKNL2がCENP-Aヒストン複合体と結合しないと分裂不全を起こすこと、2) 動原体構造の構造変化が染色体分配の鍵であることも示しています。染色体の分配不全は、がんをはじめとする様々な疾患の原因となることがわかっています。染色体の分配メカニズムを原子レベルの構造で解明することによって、各種ドラッグデザインに貢献することが期待されます。
本研究成果は、英国科学誌「EMBO Journal」に、2月6日(月)午後8時(日本時間)に公開されました。
図1. 染色体分配の模式図
図2. CENP-A複合体にKNL2が結合した構造
図3. 間期と分裂期でCENP-A複合体と結合するタンパク質は変化する
図4. KNL2は、間期ではシャペロン (HJURP)や他の複合体 (Mis18a/b ) を介してCENP-Aの取り込みに関与
研究の背景
生物のすべての遺伝情報(ゲノム)は、染色体と呼ばれる構造体に包まれ、次世代の細胞に伝達されていきます (図1)。そのため、染色体の正確な伝達は、生命を維持する上で必須ですが、染色体の伝達に問題がおこると、染色体構造に異常が生じます。これらの染色体異常は、がんやダウン症を始め、多くの病気の原因になることが知られています。したがって、染色体が正確に次世代の細胞へ伝達されるしくみを解明することは、生命を維持するための基本原理への理解につながります。それと同時に、染色体異常が原因で起こる病気 (がんやダウン症など) の発症機構の解明や抗がん剤の開発などのドラッグデザインにも貢献します。
染色体の伝達は、細胞の両極から伸びた紡錘体微小管 (紡錘糸)が染色体上のセントロメア(図1)と呼ばれるゲノム領域に形成された動原体構造を捉え、娘細胞と呼ばれる次世代の細胞へ染色体を分けることによって行われます。染色体が正確に娘細胞へ伝達されるしくみを知るためには、動原体構造が形成されるしくみを詳細に理解しなければなりません。
これまで、動原体構造の解明を目指した研究はありましたが、それらはある時点での静止画像的な解析に基づくものであり、細胞周期の進行とともに変化する動原体構造に着目した研究は、ほとんどありませんでした。特にセントロメアを構成するCENP-Aヒストン構造体に結合する動原体タンパク質としては, CENP-Cが知られていましたが、CENP-Cが恒常的にCENP-Aヒストン構造体に結合しているかは、不明でした。そこで、深川教授のグループは、細胞周期の進行に伴い、CENP-Aヒストン構造体に結合するタンパク質が変化する可能性を考えて解析しました。
研究の成果
ニワトリ細胞を用いた実験から、間期では、CENP-Cの代わりにCENP-Cに類似した配列を持つKNL2というタンパク質がCENP-Aヒストン構造体に結合することが明らかになりました。そこで、CENP-A複合体とKNL2を別々に大腸菌で発現させ精製しました。その上で、これらのタンパク質を混合し動原体構造の再構築を試みました。そこで得られたタンパク質複合体構造をクライオ電子顕微鏡観察法で解析しました。
その結果、KNL2とCENP-A複合体の構造や結合様式を原子レベルで解読が可能となり、KNL2とCENP-Aの結合領域は、CENP-CとKNL2の結合領域とほぼ一致することが判明しました (図2)。
また、KNL2がCENP-Aに結合した複合体に、リン酸化されたCENP-C (分裂期状態の模倣) を加えるとKNL2がCENP-A複合体から排除され、リン酸化されたCENP-C が優先的にCENP-Aと結合することも明らかになりました (図3)。
さらに、CENP-Aと結合できないKNL2の変異体を発現する細胞を観察すると変異KNL2は動原体へ局在せず、細胞は染色体分配の異常で死滅することが判明しました。また、その際にCENP-Aの局在も減少することから、KNL2のCENP-A結合は、新しいCENP-Aの取り込みにも重要であることが示唆されました (図4)。
これらの結果は細胞周期進行に伴う動原体構造の変化を原子レベルの構造から説明できる画期的な成果といえます。
本研究成果が社会に与える影響(本研究成果の意義)
本研究成果により、動原体の構造の変化が原子レベルで明らかとなったことで、複合体の構成因子の相互的な関係性と機能に迫ることが可能となりました。動原体の働きを積極的にコントロールすることが、抗がん剤の開発には重要と考えられていますが、今回の成果によってドラッグデザインに一歩踏み込んだ貢献ができると考えられます。
特記事項
本研究成果は、英国科学誌「EMBO Journal」に、2月6日(月)午後8時(日本時間)に公開されました。
タイトル:“The cryo-EM structure of the CENP-A nucleosome in complex with ggKNL2”
著者名:Honghui Jiang (大阪大学大学院生命機能研究科), Mariko Ariyoshi (大阪大学大学院生命機能研究科), Tetsuya Hori (大阪大学大学院生命機能研究科), Reito Watanabe (大阪大学大学院生命機能研究科), Fumiaki Makino (大阪大学大学院生命機能研究科, 日本電子株式会社), Keiichi Namba (大阪大学大学院生命機能研究科), and Tatsuo Fukagawa* (大阪大学大学院生命機能研究科)
*責任著者
以下の研究費の支援によって行われました。
・ JST戦略的創造研究推進事業 CREST「動原体超分子複合体の構造ダイナミクス」(研究代表:深川竜郎(大阪大学大学院生命機能研究科教授))
・ 科学研究費補助金 基盤研究(A)「セントロメア/動原体機能の包括的理解」(研究代表:深川竜郎(大阪大学大学院生命機能研究科教授))
・ 科学研究費補助金 新学術領域研究「非ゲノム情報によって制御されるセントロメアの維持・形成機構」(研究代表:深川竜郎(大阪大学大学院生命機能研究科教授))
・科学研究費補助金 学術変革領域研究「セントロメアモダリティの理解」(研究代表:深川竜郎(大阪大学大学院生命機能研究科教授))
参考URL
SDGsの目標
用語説明
- 染色体分配
細胞には、遺伝情報を含んだ染色体が複数本存在する。これら染色体は、細胞が分裂して増える前に2つにコピーされ、細胞分裂にともない次世代の細胞に分けられなければならない。このコピーされた染色体を子孫の細胞へ均等に受け渡すことを染色体分配という。(図1)
- 動原体
染色体上のセントロメア領域に形成される巨大なタンパク質複合体。細胞分裂が起こるとき、染色体を引っ張る糸(微小管)と結合し、染色体と微小管との結合を仲介することで染色体分配の過程で重要な働きをする。
- セントロメア
染色体のほぼ中央にあるくびれた部分のゲノム領域をさす。細胞分裂の際、染色体分配に重要なゲノム領域であり、紡錘糸が結合する動原体構造が形成される領域である。他のゲノム領域と区別されるために通常のヒストンの代わりにCENP-Aという特殊なヒストンが取り込まれる。
- 間期
増殖する細胞は、一連のサイクルを経て1つの細胞から2つになるが、その過程の一連の事象を細胞周期という。細胞周期のうち、細胞が分かれる段階を分裂期と呼ぶのに対して、それ以外を間期と呼ぶ。間期は、G1期、S期、G2期に分かれる。
- KNL2
動原体タンパク質の一種であり、CENP-Cに類似した配列をもつ。今回の解析で、CENP-Aヒストン複合体 (ヌクレオソーム) (CENP-Aの欄参照)と結合することが明らかになった (図2)。
- CENP-C
CENP-A 複合体に結合する動原体タンパク質の一種。また、他の動原体因子とも結合され、動原体構造のハブと考えられている。
- ヒストン
DNA分子を巻きつかせることで、DNAを核内に収納する役割を担う塩基性タンパク質。H2A、H2B、H3、H4のコア構造が2分子ずつ含む8量体にDNAが巻き付いた構造をヌクレオソームと呼び、細胞核内のDNAの基本構造となる。真核細胞のDNAは基本的にヒストンに巻き付いて存在する。
- CENP-A
セントロメア領域に存在するヒストンH3の派生体。セントロメア領域のヌクレオソーム(上記ヒストンの欄参照)も8量体からなるが、通常のヌクレオソームと異なり、H3の代わりにCENP-Aが含まれている。このCENP-Aヒストン複合体 (ヌクレオソーム)に他の動原体タンパク質が結合して動原体が形成される。
- リン酸化
タンパク質のリン酸化は、生物に存在する重要な調節機構であり、キナーゼと呼ばれる酵素によって行われる。リン酸化はタンパク質のセリン、スレオニン、そしてチロシンの残基に起こる。リン酸化の調節の例として、Cdk1キナーゼによって細胞周期の進行が制御される例は有名である。


