世界初!!クリプトコッカス独自の細胞分裂機構を解明
クリプトコッカス症治療に期待
研究成果のポイント
- クリプトコッカス(Cryptococcus neoformans)(真菌の一種)固有の細胞分裂機構を発見
- これまでヒトの染色体分配で知られていたしくみと異なる新しい装置をクリプトコッカスにて発見
- 染色体分配経路で働くクリプトコッカス固有の新規タンパク質を発見、”Bridgin” (ブリッジン)と命名
- クリプトコッカス症に対する治療薬の開発に期待
概要
大阪大学大学院生命機能研究科のShreyas Sridhar (シェリヤス スライダー) 特任助教・深川竜郎教授らの研究グループは、インドJNCASRと共同で、クリプトコッカス症の原因として知られるクリプトコッカス独自の細胞分裂機構を明らかにしました。特にエイズ患者によくみられるクリプトコッカス症に対する治療薬の開発が期待されます。
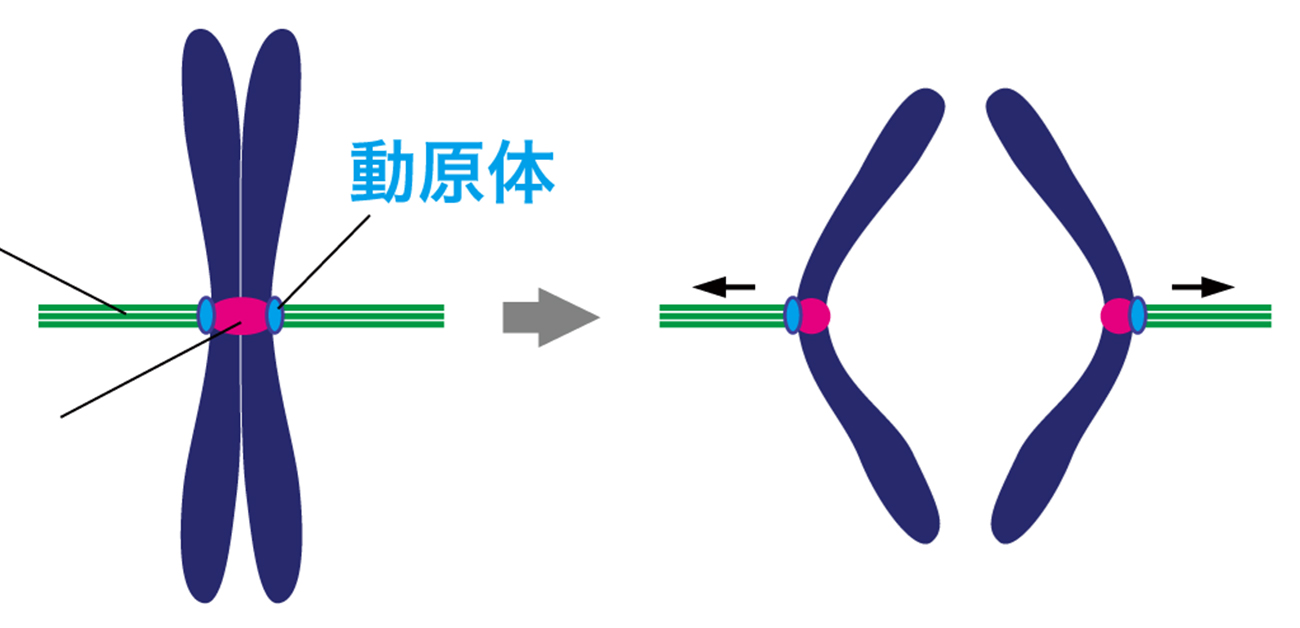
今回、本研究グループは、クリプトコッカス (Cryptococcus neoformans)を用いて、染色体の分配 (図1)に必須な動原体のタンパク質を解析した結果、どの生物の動原体にも存在しない新規タンパク質”Bridgin”(ブリッジン)を同定しました (図2)。
興味深いことにブリッジンは、染色体上のゲノムDNAにも分配装置の微小管局在タンパク質にも結合して、染色体を微小管へ“橋渡し”する重要な機能を担うことが判明しました。他の生物では、この“橋渡し”機能は別のタンパク質によって担われているので、クリプトコッカス固有の機能であると言えます。この固有のしくみに注目して、クリプトコッカスの増殖を選択的に抑えることで、クリプトコッカス症に対する治療薬の開発が期待されます。
本研究成果は、英国科学誌「Nature Communications」に、1月8日(金)午後7時(日本時間)に公開されました。
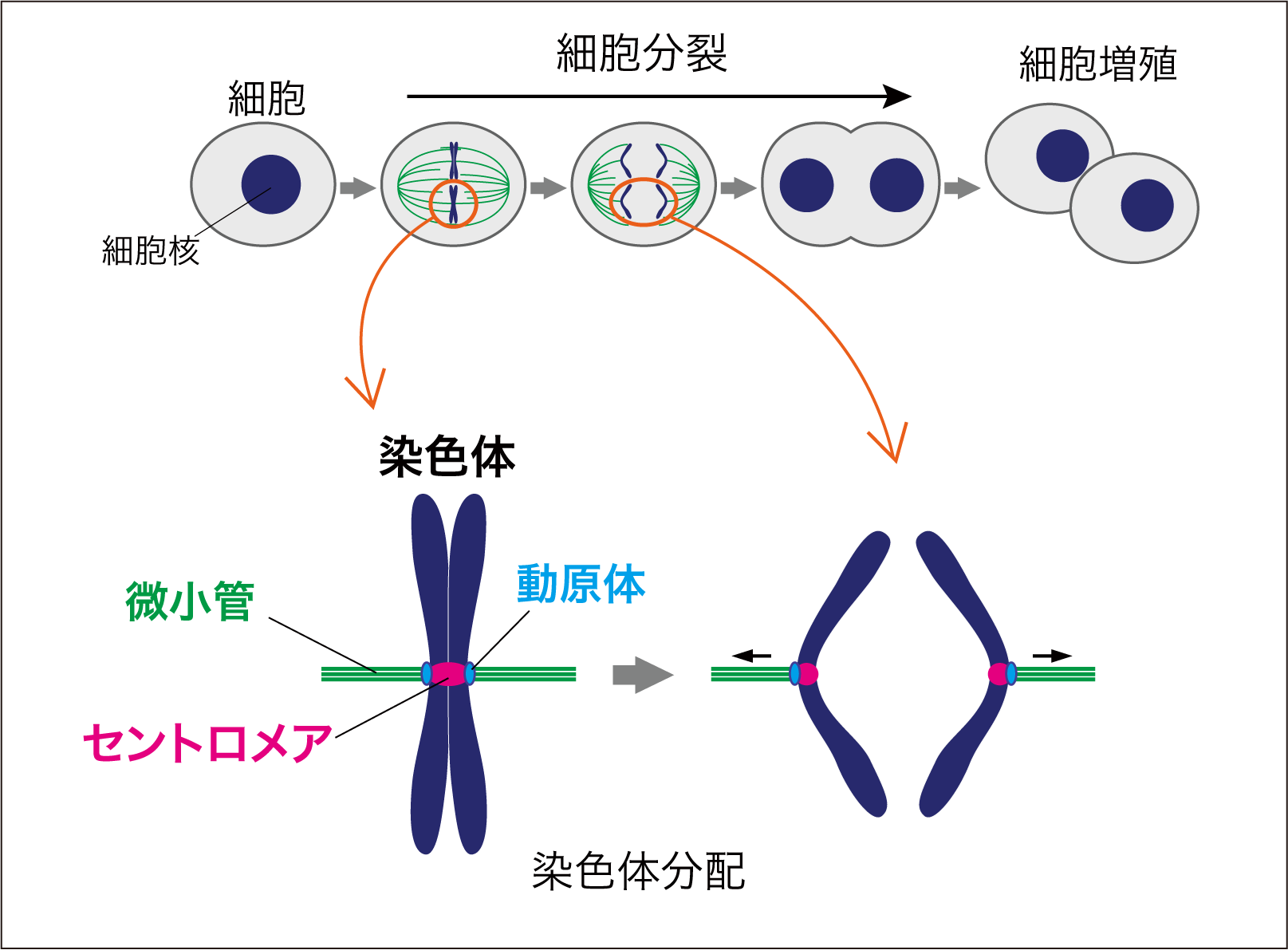
図1 染色体分配の模式図
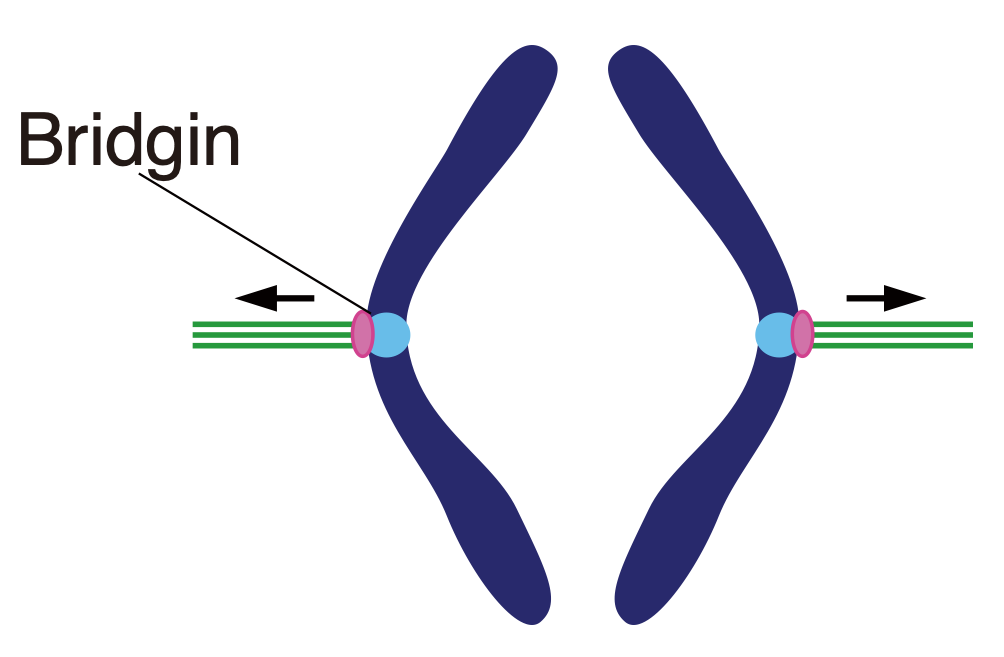
図2 新規動原体タンパク質Bridgin(ブリッジン)の発見
研究の背景
ヒトを含む全ての生物が、生命を維持するためには、細胞分裂が必要です。この細胞分裂の過程において、細胞が持つ遺伝情報 (ゲノム情報)を正確に次世代の細胞へ伝えることは生物の生存に欠かせない大事なしくみです。この遺伝情報の受け渡しは、全ゲノム情報が含まれる染色体が正しく次世代の細胞に分けられる「染色体分配」によって成り立っています。染色体分配に異常が生じると、遺伝情報が正しく次世代細胞へ伝わらなくなり、多くの細胞は死滅します。
染色体分配は、染色体上に形成される動原体と呼ばれる構造が染色体を引っ張る糸、微小管との結合を橋渡しして、行われます。この動原体は、染色体上のセントロメアと呼ばれるごく限られたゲノム領域にのみ形成されます。動原体は、ゲノムDNA上のセントロメアにも、微小管にも同時にくっつかなければなりません。これまで、ヒトの細胞などでは、動原体複合体について多くの研究が行われ、それを構成するタンパク質が数10種類以上同定されています。そのうち、ゲノムDNAに結合するタンパク質や微小管と結合するタンパク質も知られていました (図3)。
一方で、予想に反して、動原体の構成は生物間でそれほど似ていないことも分かってきました。今回、研究グループは、クリプトコッカス症の原因菌であるクリプトコッカスに注目して動原体の構成を調べました。
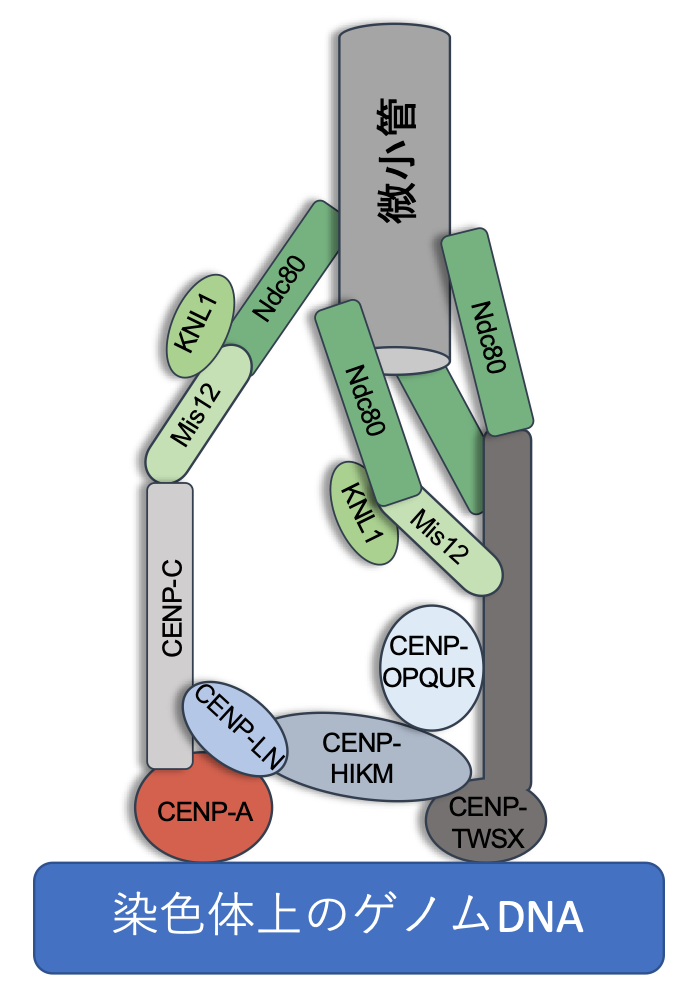
図3 ヒトの動原体タンパク質の構成。多様なタンパク質で構成されている。
本研究成果
研究グループは、クリプトコッカスのゲノム配列から動原体タンパク質候補を探索した結果、一部のタンパク質はヒトの動原体タンパク質と類似しているものの、ヒトに存在する関連タンパク質に対応する候補因子が存在しない可能性があることに気がつきました。
そこで、クリプトコッカス独自の動原体タンパク質を見つける目的で、既知の動原体タンパク質と結合するタンパク質を精製しました。その結果、どの生物の動原体にも存在しない新規のタンパク質を発見しました。
様々な解析を行った結果、この新規のタンパク質は、動原体に存在し、ゲノムDNAにも、微小管局在タンパク質にも結合することが判明し、”Bridgin”(ブリッジン)と命名しました (図4)。
ブリッジンは、染色体分配に必須であり、クリプトコッカスの重要な動原体タンパク質と言えます。他の生物の動原体タンパク質と異なりDNA結合領域は、ヒトのKi67と呼ばれる染色体構成タンパク質と似ています。そこで、クリプトコッカスのブリッジンのDNA結合領域をヒトのKi67のDNA結合領域に置き換えて実験した結果、ヒトKi67と置き換えたブリッジンは、正常に機能することが分かりました。
動原体のDNAから微小管への橋渡し機能は、多くの生物では、CENP-CあるいはCENP-Tと呼ばれるタンパク質によって担われていることが知られています (図3)。クリプトコッカスでは、CENP-Cは存在しますが、CENP-Tは存在しないので、ブリッジンの橋渡し機能は、クリプトコッカス独自の機能と言えます。
CENP-Cの機能阻害は、ヒト細胞の増殖も抑えてしまうので、CENP-C阻害は薬剤のターゲットにはなりえませんが、ブリッジンを選択的に阻害することで、クリプトコッカスのみの増殖を抑えられることが期待されます。
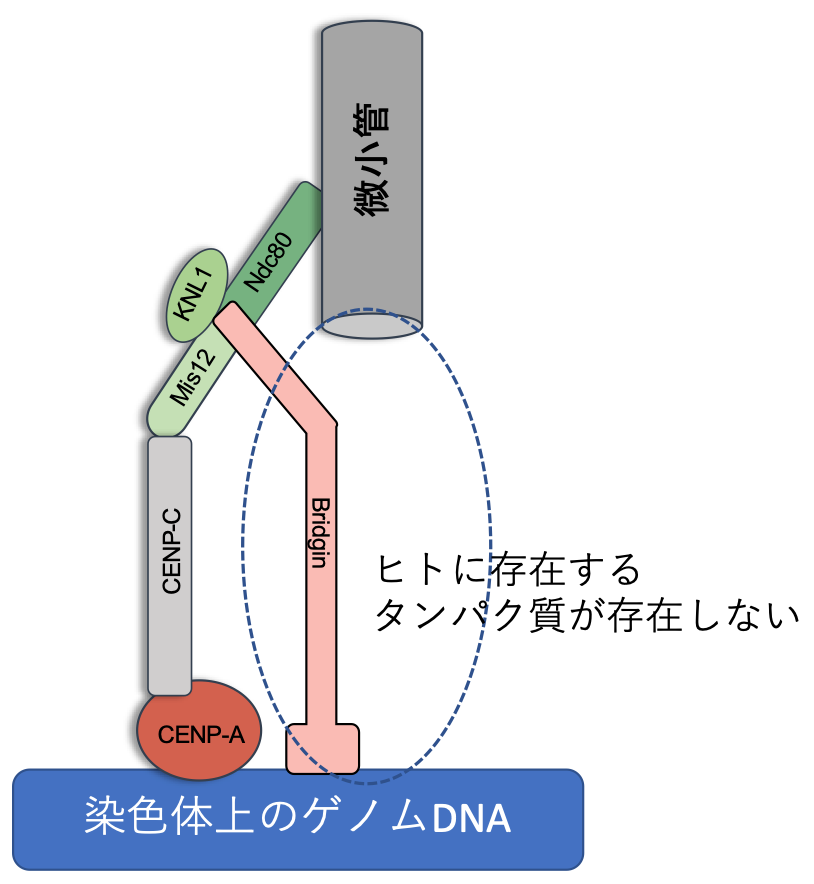
図4 クリプトコッカスの動原体タンパク質の構成。ブリッジンがゲノムと微小管の橋渡しをしている。
本研究成果が社会に与える影響(本研究成果の意義)
本研究成果により、クリプトコッカス独自の染色体分配機構が明らかになりました。その結果、クリプトコッカスを選択的に増殖抑制できるので、エイズ患者などで多くみられるクリプトコッカス症の治療薬の開発に貢献できると考えられます。
特記事項
本研究成果は、英国科学誌「Nature Communications」に、1月8日(金)午後7時(日本時間)に公開されました。
タイトル:“Bridgin connects the outer kinetochore to centromeric chromatin”
著者名:Shreyas Sridhar (大阪大学大学院生命機能研究科), Tetsuya Hori (大阪大学大学院生命機能), Reiko Nakagawa (理化学研究所BDR), Tatsuo Fukagawa* (大阪大学大学院生命機能研究科), and Kaustuv Sanyal* (JNCASR・大阪大学大学院生命機能研究科) *共同責任著者
以下の研究費の支援によって行われました。
- 科学研究費補助金 基盤研究(S)「染色体分配に必須なセントロメアの形成機構の解明」(研究代表:深川竜郎(大阪大学大学院生命機能研究科教授))
- 科学研究費補助金 新学術領域研究「非ゲノム情報によって制御されるセントロメアの維持・形成機構」(研究代表:深川竜郎(大阪大学大学院生命機能研究科教授))
- 大阪大学国際共同研究促進プログラムタイプA (研究代表:深川竜郎(大阪大学大学院生命機能研究科教授))
参考URL
生命機能研究科 深川研究室HP
https://www.fbs.osaka-u.ac.jp/labs/fukagawa/index_j.html
用語説明
- クリプトコッカス(Cryptococcus neoformans)
Cryptococcus 属は担子菌類に分類される、酵母様真菌。C. neoformansは世界中に分布しており、鳥(特にハト)の糞で汚染された土壌中に存在し、重篤な髄膜炎を惹起する菌種も含みクリプトコッカス症の原因菌として知られている。C. neoformans が新たな基準種として取り扱われ、2005 年には C. neofor- mans のゲノムが解読されている。
- 染色体分配
細胞には、遺伝情報を含んだ染色体が複数存在する。これら染色体は、細胞が分裂して増える前に2つにコピーされ、細胞分裂にともない次世代の細胞に分けられなければならない。このコピーされた染色体を子孫の細胞へ均等に受け渡すことを染色体分配という。(図1)
- クリプトコッカス症
Cryptococcus neoformans (クリプトコッカス)によって引き起こされる感染症で、頭痛や錯乱、せきや胸痛、または発疹が出ることがある。エイズなど免疫機能が低下している場合に罹患して重篤化する場合もある。エイズが流行し始めるまでは、この感染症は比較的まれだったが、現在ではエイズ患者に最も一般的な、死に至る可能性がある真菌感染症と考えられている。
- 動原体
染色体上に形成される巨大なタンパク質複合体。細胞分裂が起こるとき、染色体を引っ張る糸(微小管)と結合し、染色体と微小管との結合を仲介することで染色体分配の過程で重要な働きをする。
- 微小管
真核生物の細胞内に存在する主要な細胞骨格の一つ。チューブリンというタンパク質が繊維状につながった直径約25nmの管状の構造であり、細胞の形態維持や変化、細胞内の物質輸送、細胞分裂など多様な機能に重要な役割を果たしている。
- セントロメア
動原体が形成される染色体上の特殊な領域。通常、染色体あたり1カ所存在し、その領域には生物種に固有なDNA配列が高度に反復した構造がある場合が多い。
- Ki67
人の染色体構成タンパク質。分裂細胞のマーカーとして利用されている。染色体の表面上に存在して、染色体同士が絡まないような界面活性剤の役割を果たしている。
