なぜ老化は生活習慣病を引き起こすのか?
オートファジー阻害による新規治療戦略
研究成果のポイント
・加齢に伴い脂肪細胞の機能が低下し、それが原因となって種々の生活習慣病が発症することが知られていたが、その理由はこれまで不明であった。
・脂肪細胞では、他の多くの臓器とは逆に、オートファジー 抑制因子であるRubicon(ルビコン) が加齢に伴い減少することでオートファジーが過剰になり、その結果、脂肪細胞の機能が低下し、生活習慣病を引き起こすことを明らかにした。
・脂肪細胞に対するオートファジー阻害が生活習慣病の新たな治療戦略となることが期待される。
概要
大阪大学大学院医学系研究科の山室禎 研究生(遺伝学)、医学系研究科兼生命機能研究科の吉森保 教授(遺伝学/細胞内膜動態研究室)のグループは医学系研究科の下村伊一郎 教授(内分泌・代謝内科学)らと共同で、生活習慣病を予防する働きのある脂肪細胞において、加齢に伴いオートファジーが過剰となった結果、脂肪細胞の機能を低下させて生活習慣病を引き起こすこと及びその背景にあるメカニズムを明らかにしました。
本研究グループはこれまでに、オートファジー抑制因子であるRubiconが肝臓や腎臓など多くの臓器で老化に伴い蓄積し、オートファジーを低下させて加齢性の臓器障害を引き起こすことを明らかにしてきました。今回、脂肪組織では、逆に、老化に伴いRubiconが顕著に減少してオートファジーが過剰になることを見出しました。続いて、脂肪細胞でRubiconを抑制してオートファジーを過剰にしたマウスを作成したところ、このマウスは糖尿病や脂肪肝などの生活習慣病を発症しました。さらに、過剰なオートファジーは、脂肪細胞機能に重要な働きのあるSRC-1とTIF2という2つのタンパク質を分解し、減少させていることが判明しました。これにより、脂肪細胞の分化や機能に重要な働きをしているPPARγ の働きが弱まり、脂肪細胞の機能が低下して生活習慣病を引き起こすと考えられます (図1) 。これらの結果から、Rubiconが脂肪細胞で加齢に伴い減少し、過剰になったオートファジーが脂肪細胞機能を低下させ、生活習慣病を引き起こしていることを示唆するとともに、脂肪細胞でのオートファジー阻害が生活習慣病の新規治療戦略になることが期待されます。
本研究成果は、英国科学誌「Nature Communications」に、8月18日(火)午後6時(日本時間)に公開されました。
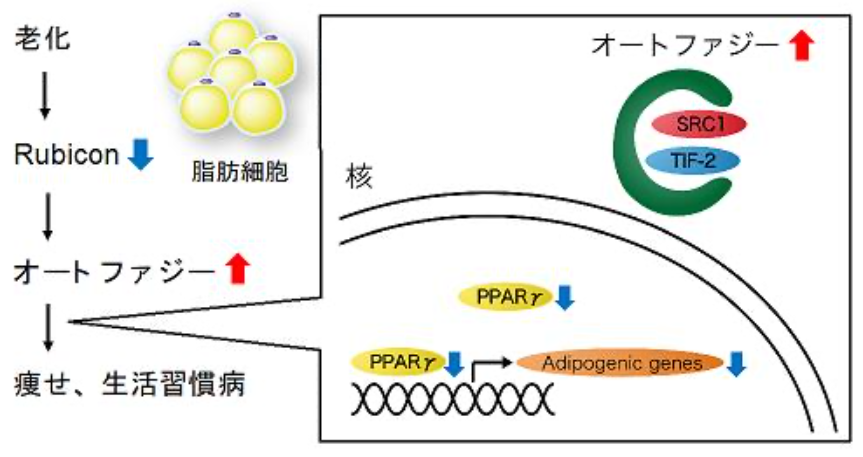
図1 脂肪細胞の老化過程
加齢に伴い、脂肪組織のRubiconが減少し、オートファジーが過剰になる。過剰なオートファジーはSRC-1とTIF2を分解し、PPARγ活性と脂肪細胞機能の低下を招き、このことが生活習慣病につながる。
研究の背景
脂肪細胞は糖や脂質といった栄養を自らに貯め込み、レプチンやアディポネクチンといったホルモンを分泌し、肝臓や筋肉での栄養取り込みを促します。これらの役割を担うことで、脂肪細胞は血糖値や血中の中性脂肪値、コレステロール値を正常に保っています。老化によって脂肪細胞の機能が徐々に低下し、この機能低下が糖尿病や脂質異常症、脂肪肝といった生活習慣病の原因になることがこれまでの研究で明らかになっています。しかしながら、加齢に伴い脂肪細胞の機能が低下するメカニズムは不明なままでした。
オートファジーは細胞内の構成成分を分解する仕組みであり、新陳代謝を担うことで細胞の健康を維持しています。そのためオートファジーは様々な疾患を抑制しうることが明らかになっており、オートファジー機構を発見した大隅良典博士は2016年にノーベル医学・生理学賞を受賞されました。本研究グループの吉森教授らは昨年、Rubiconというオートファジーの抑制因子が肝臓や腎臓など多くの臓器で加齢に伴って蓄積し、オートファジーを低下させることで老化を促進していることを明らかにしました。その一方で、脂肪細胞のオートファジーが老化に伴いどのように変化するのか、そしてその変化は生活習慣病の発症にどう影響するのかは未解明でした。本研究グループは、これを明らかにするため、老化過程における脂肪細胞のRubiconに着目して研究を行いました。
本研究の成果
まず、老化個体の脂肪組織におけるRubiconの発現量を調べたところ、驚くべきことに、他の多くの臓器とは異なり、脂肪組織では加齢に伴いRubiconが顕著に低下していました。それに伴い、オートファジーが過剰になっていることが判明しました。次に、脂肪細胞でRubicon遺伝子を欠損させ、オートファジーを過剰にしたノックアウトマウスを作成しました。すると、このマウスは若齢にもかかわらず痩せと耐糖能異常 を示しました (図2) 。加えて、血中中性脂肪やコレステロールの増加、脂肪肝などの症状も示し、このマウスの症状は高齢者の痩せや生活習慣病と類似していると考えられました。さらに、脂肪細胞でオートファジーを抑制したマウスを老化させたところ、このマウスでは加齢性の脂肪肝が改善しました (図3) 。これらの結果から、脂肪組織のオートファジー過剰が高齢者の痩せや生活習慣病の原因となっており、これを抑えることで生活習慣病を治療しうることが示唆されました。Rubiconを抑制してオートファジーを過剰にした脂肪細胞の遺伝子発現を解析したところ、PPARγという脂肪細胞機能に必須のタンパク質の働きが低下していることが分かりました。PPARγの発現量はRubiconを抑制しても変わらなかったため、PPARγの働きを助けることで知られるSRC-1とTIF2という2つのタンパク質について調べたところ、これらがオートファジーによって分解されていることが判明しました。つまり、老化個体の脂肪細胞でRubiconが低下してオートファジーが過剰になると、SRC-1とTIF2が分解されて減少します。そのためPPARγの働きが弱まり、脂肪細胞の機能が低下して生活習慣病を引き起こすと考えられました (図1) 。なお個体が飢餓に晒された際にも、脂肪細胞のRubiconが減少してオートファジーを高め、SRC-1とTIF2が分解されることを確認しています。これは脂肪細胞の機能を積極的に下げることで、脂肪細胞に貯蔵できなくなった栄養を、飢餓の際に他の細胞に利用させるためと考えられます。つまり、この機構は飢餓という有事のために存在しているのですが、老化によってこの機構が誤って働いてしまい、その結果生活習慣病を引き起こすのではないかと考えています。
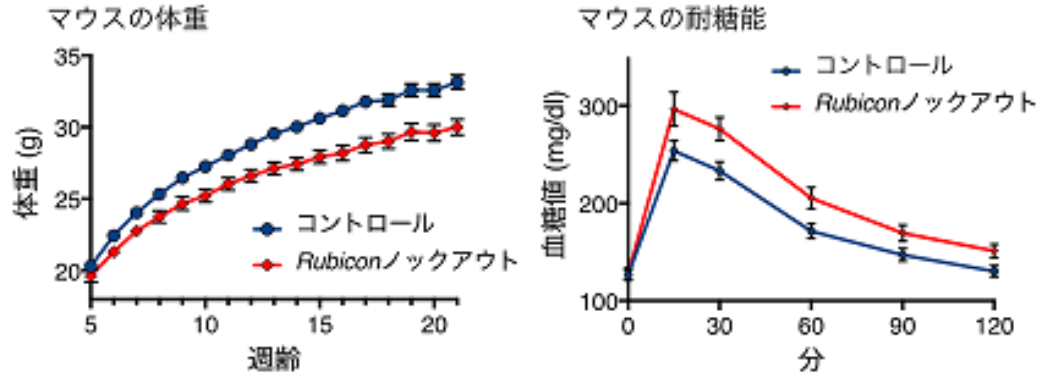
図2 脂肪組織でRubicon遺伝子を欠損すると、痩せと耐糖能異常を示す
(左:マウスの体重経過)5週齢から21週齢にかけての体重経過を示す。コントロールと比較し、脂肪細胞でRubicon遺伝子を欠損したマウスは体重増加不良をきたしており、痩せを示している。
(右:マウスの耐糖能)ブドウ糖を注射した後の血糖値の推移を示す。コントロールと比較し、脂肪細胞でRubicon遺伝子を欠損したマウスでは血糖値が高く推移しており、耐糖能異常を示している。
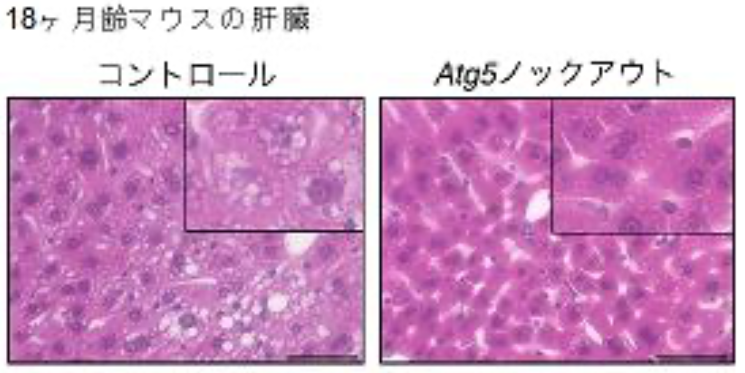
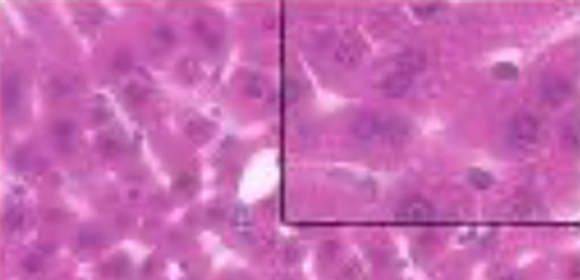
図3 脂肪組織でオートファジーを抑制すると、加齢性の脂肪肝が改善する
(マウスの肝臓)18ヶ月齢マウスの肝臓組織のHematoxylin-Eosin染色像を示す。コントロールと比較し、脂肪細胞でAtg5遺伝子を欠損(ノックアウト)してオートファジーを抑制したマウスでは脂肪滴が減少しており、脂肪肝の改善を示している。
本研究成果が社会に与える影響(本研究成果の意義)
65歳以上の高齢者の割合が28%を超え、超高齢社会となった日本では、糖尿病や脂質異常症、脂肪肝といった生活習慣病が増加しています。それに伴い、これらを原因とする虚血性心疾患や脳卒中といった致死的な動脈硬化性疾患の増加が問題となっています。本研究では、老化に伴い脂肪細胞のオートファジーが過剰となり、生活習慣病の原因となることが明らかになりました。脂肪細胞のオートファジーを抑制すると加齢性の脂肪肝が改善することも見出しており、今後、脂肪細胞のオートファジー阻害による生活習慣病の創薬が期待されます。
特記事項
本研究成果は、2020年8月18日(火)午後6時(日本時間)に英国科学誌「Nature Communications」(オンライン)に掲載されました。
【タイトル】"Age-dependent loss of adipose Rubicon promotes metabolic disorders via excess autophagy"
【著者名】
Tadashi Yamamuro 1 , Tsuyoshi Kawabata 1,2,3 , Atsunori Fukuhara 4,5 , Shotaro Saita 1,2 , Shuhei Nakamura 1,2,6 , Hikari Takeshita 7 , Mari Fujiwara 1 , Yusuke Enokidani 1 , Gota Yoshida <1/sup>, Keisuke Tabata 1,2 , Maho Hamasaki 1,2 , Akiko Kuma 1,2 , Koichi Yamamoto 7 , Iichiro Shimomura 4 *, and Tamotsu Yoshimori 1,2,8 * (*共同責任著者)
【所属】
1 大阪大学 大学院医学系研究科 遺伝学
2 大阪大学 大学院生命機能研究科 細胞内膜動態学
3 長崎大学 原爆後障害医療研究所
4 大阪大学 大学院医学系研究科 内分泌・代謝内科学
5 大阪大学 大学院医学系研究科 肥満脂肪病態学
6 大阪大学 高等共創研究院
7 大阪大学 大学院医学系研究科 老年・総合内科学
8 大阪大学 先導的学際研究機構 生命医科学融合フロンティア研究部門
なお、本研究は国立研究開発法人 日本医療研究開発機構(AMED)「老化メカニズムの解明・制御プロジェクト」、日本学術振興会科学研究費補助金によりサポートされる研究の一環として行われ、大阪大学大学院医学系研究科老年・総合内科学との共同研究で行われました。
研究者のコメント
山室禎 研究生
多くの臓器では老化に伴いオートファジーが低下しますが、脂肪細胞では加齢に伴いオートファジーが過剰となり、生活習慣病の発症につながりうることが示されました。過ぎたるは猶及ばざるが如しという言葉の通り、オートファジーが高い方が良い、という潮流に一石を投じる結果だと考えています。
参考URL
生命機能研究科 吉森研究室HP
https://yoshimori-lab.com
用語説明
- オートファジー
細胞内の不要な構造物を分解し、新陳代謝を担っている機構である。オートファジーでは、まず隔離膜と呼ばれる扁平な膜が細胞質内に出現し、分解基質を取り囲みながらオートファゴソームを形成する。このオートファゴソームが分解酵素を多量に含むリソソームと融合し、内容物を分解する。不要物の蓄積を防ぐことで、オートファジーは様々な疾患の発症を抑制していると考えられている。その重要性が認められ、2016年に大隅良典博士がオートファジー機構の発見をしてノーベル医学・生理学賞を受賞された。
- Rubicon
(Run domain Beclin-1 interacting and cysteine-rich containing protein):
本研究グループの吉森教授らが2009年に発見したタンパク質であり、数少ないオートファジーの抑制因子として知られる。オートファジーの後期過程であるオートファゴソームとリソソームの融合を負に制御している。肝臓や腎臓、神経系でRubiconを抑制するとオートファジー活性が増加し、加齢や肥満による疾患が改善することがこれまでに明らかとなっている。
- PPARγ
(Peroxisome Proliferator-Activated Receptor γ):
脂肪細胞の分化や機能に重要な働きをしているタンパク質である。栄養の取り込みや貯蔵に関わるタンパク質など、脂肪細胞の働きに必要な多数のタンパク質の発現を誘導・維持している。このタンパク質の働きが低下すると、脂肪細胞の働きは低下し、生活習慣病の症状をきたすことが知られている。また、PPARγ活性化剤は糖尿病の治療薬として用いられている。
- 耐糖能異常
血中のブドウ糖を正常に保つ能力のことを耐糖能といい、これに異常のある状態。具体的には、ブドウ糖を経口ないし注射で投与し、その後上がった血糖値の正常化に遅れがあることをいう。ヒトの糖尿病を含む概念であり、糖尿病の前段階のことを耐糖能異常と表現することもある。
