血管・脂肪組織に由来する因子Favineが 「動脈硬化症」と「血栓症」に関与
ヒト動脈硬化症を模倣するモデルマウスを初構築
研究成果のポイント
概要
大阪大学大学院医学系研究科の小林祥子 助教(内分泌・代謝内科学)、喜多俊文 寄附講座講師(肥満脂肪病態学)、福原淳範 寄附講座准教授(肥満脂肪病態学)、下村伊一郎 教授(内分泌・代謝内科学)らの研究グループは、血管・脂肪組織由来分泌因子Favine/CCDC3が、動脈硬化症におけるプラークと石灰化の形成ならびに血栓形成に関与していることを明らかにしました。
心血管疾患による死亡(心血管死)は世界中で増加傾向にあります。心血管死の主な原因は動脈硬化症であり、全世界人口の3割が動脈硬化症を有します。しかし、動脈硬化症の発症と進展の機序については未解明な点が多く存在します。これまで、ヒトの動脈硬化症を模倣する実験モデルマウスが存在しないことが、動脈硬化症に関する研究における障壁となっていました。
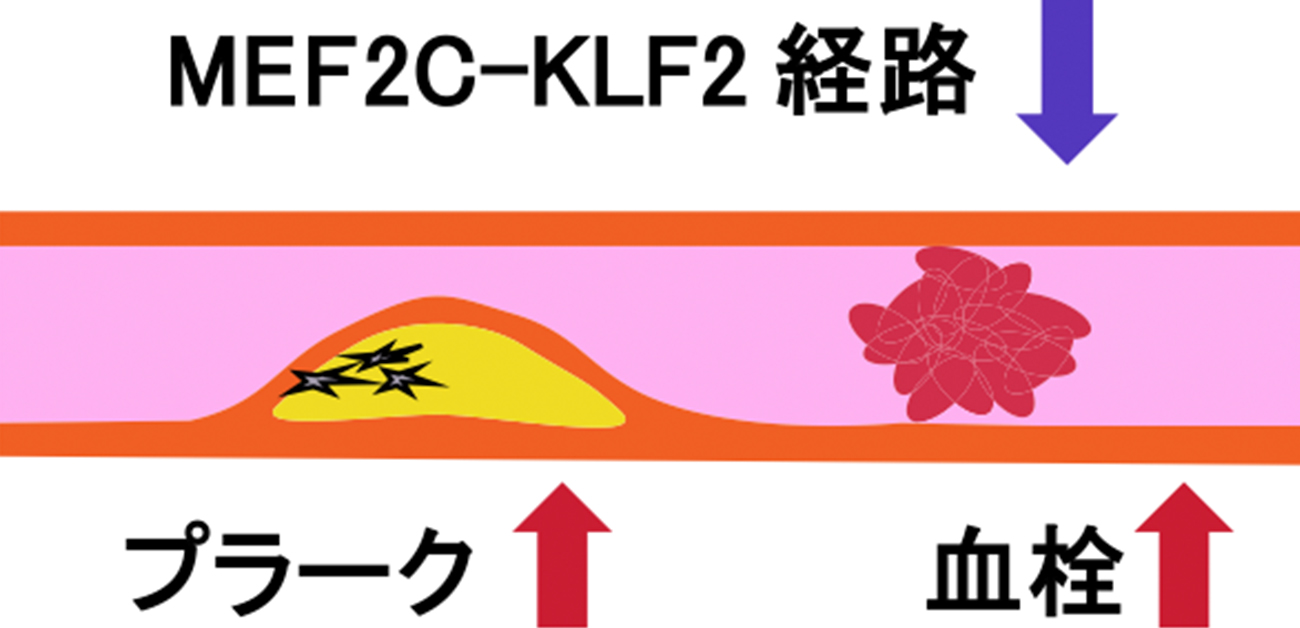
今回、下村教授らの研究グループは、Favine/CCDC3欠損マウスの大動脈や心臓の特徴を解析することにより、マウスのFavine欠損がヒトの動脈硬化症のプラークに類似する石灰化の形成ならびに血栓形成を促進することを発見しました。さらにヒト動脈硬化症の動脈ではFavine/CCDC3が減少することを見出しました。これらにより、動脈硬化症と血栓症の新たなバイオマーカーの確立と新しい治療法の開発が期待されます。
本研究成果は、10月3日(月)(日本時間)に米国科学誌「iScience」(オンライン)に掲載されました。
図. アポリポタンパクE欠損マウスに遺伝子改変を行って作成したFavine/アポリポタンパクE欠損マウスでは、動脈硬化が進行し、石灰化と血栓形成が認められた。ヒトの動脈硬化症の血管ではFavine遺伝子発現量が低下した。
研究の背景
動脈硬化症の進展によって、プラークと石灰化と血栓形成が引き起こされることが知られていましたが、それらの機序に関しては依然不明な点が多く存在します。これまで、ヒトの動脈硬化症を模倣する実験モデルマウスとしてアポリポタンパクE欠損マウスが広く使われてきました。しかし、アポリポタンパクE欠損マウスの血管ではプラーク形成が見られますが、石灰化や血栓形成を引き起こすことはまれであり、ヒトの動脈硬化症を模倣する実験モデルマウスが存在しないことも動脈硬化症の研究における問題点でした。下村教授らの研究グループは、2010年に血管・脂肪組織由来分泌因子Favine/CCDC3を世界で初めて同定し、Favineの機能解析を行ってきました。
研究の内容
下村教授らの研究グループでは、FavineとアポリポタンパクEを同時に欠損するマウスを作製し、このマウスがヒトの動脈硬化症に類似するプラークと石灰化、そして血栓形成を引き起こすことを発見しました。このマウスの大動脈における遺伝子の網羅的な解析や血管内皮細胞の実験から、Favine欠損によって血管の恒常性に重要なMEF2C、KLF2に関する経路が低下することも見出しました。
さらに、ヒトの動脈硬化症患者の血管では、Favine遺伝子発現が低下することも明らかにしました。
本研究成果が社会に与える影響(本研究成果の意義)
本研究成果により、動脈硬化症と血栓症の治療や予防に関わる創薬やバイオマーカーの開発につながり、人類の健康寿命の延長に貢献できることが期待されます。
特記事項
本研究成果は、10月3日(月)(日本時間)に米国科学誌「iScience」(オンライン)に掲載されました。
タイトル:“Favine/CCDC3 deficiency accelerated atherosclerosis and thrombus formation is associated with decreased MEF2C-KLF2 pathway.”
著者名:Sachiko Kobayashi1,10*, Shunbun Kita1,2*, Daisuke Okuzaki3, Yuya Fujishima1, Michio Otsuki1,4, Hisashi Kato5, Yasuko Nishizawa6, Kazuya Miyashita7, Chieko Yokoyama1,8, Atsunori Fukuhara1,2, Eiichi Morii9, and Iichiro Shimomura1(*責任著者)
所属:
1. 大阪大学 大学院医学系研究科 内分泌・代謝内科学
2. 大阪大学 大学院医学系研究科 肥満脂肪病態学
3. 大阪大学 免疫学フロンティア研究センター
4. 東京女子医科大学 内分泌内科学分野
5. 大阪大学 大学院医学系研究科 血液・腫瘍内科学
6. 野崎徳洲会病院
7. 株式会社免疫生物研究所
8. 神奈川工科大学 健康医療科学部
9. 大阪大学 大学院医学系研究科 病態病理学
10. Lead contact
DOI:https://doi.org/10.1016/j.isci.2022.105252
本研究は、日本学術振興会科学研究費助成、公益財団法人日本応用酵素協会助成研究、公益財団法人MSD生命科学財団助成研究の一環として行われました。
参考URL
下村伊一郎教授 研究者総覧
htps://rd.iai.osaka-u.ac.jp/ja/3e3872c137fac11b.html
SDGsの目標
用語説明
- Favine
小林助教、下村教授らが2010年に同定した因子。別名はCCDC3。血管と脂肪組織に高く発現する。脂肪細胞の分化と脂肪合成を促進させる作用を有することを同研究グループが発見した。
- 動脈硬化症
心臓から送り出される血液を全身に運ぶ血管を動脈と呼ぶ。動脈の壁が厚くなり硬くなる状態が動脈硬化症である。
- プラーク
動脈の内側に沈着する物質。脂質、炎症細胞、結合組織などがその構成成分である。
- 石灰化
血管にカルシウムが沈着すること。動脈硬化症や慢性腎臓病の患者さんの血管で見られる。石灰化 を伴うプラークは破裂しやすく、石灰化のある血管の壁は固くなる。アポリポタンパクE血液中に存在する。脂質やコレステロールの代謝の調節に重要な役割を果たしている。
- MEF2C
筋細胞や心筋細胞の発生に必要な遺伝子群の発現を制御する蛋白質である。血管の恒常性においても重要な働きを有する。
- KLF2
肺や赤血球の形成に必要な遺伝子群の発現を制御する蛋白質である。血管内皮細胞や免疫細胞の恒常性においても重要な働きを有する。

