自己免疫を起こさないがん免疫活性化法を開発
腫瘍随伴マクロファージのPF4は、がん免疫を抑制するTh1-Tregを誘導する
研究成果のポイント
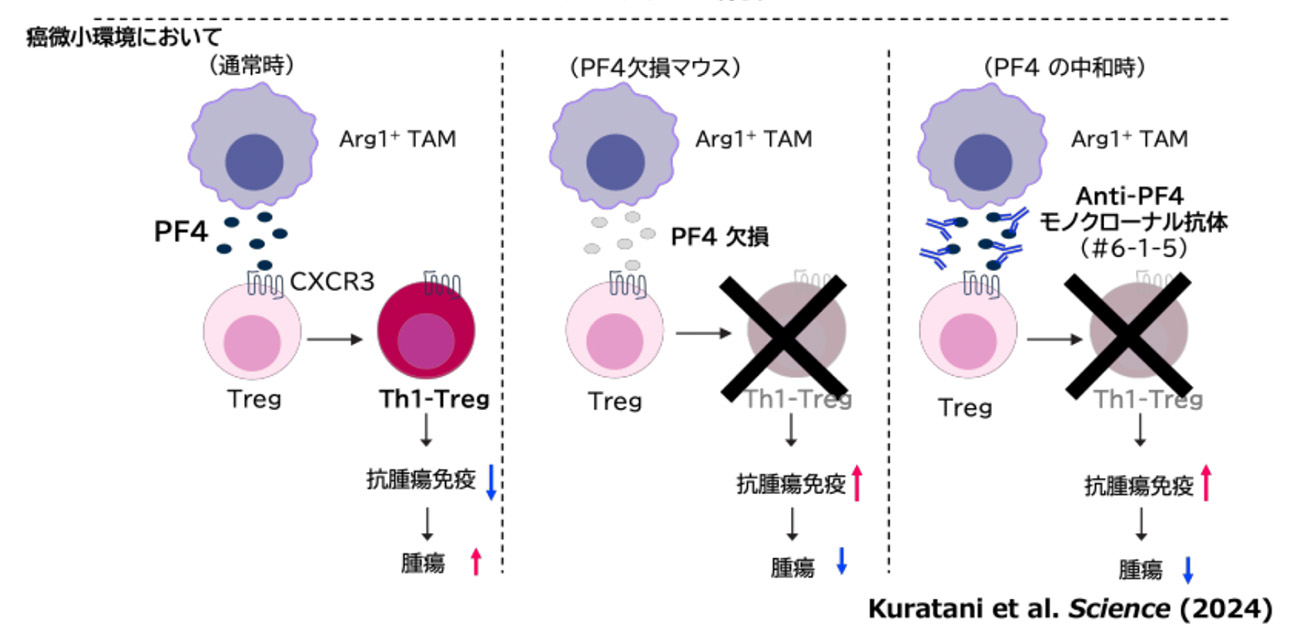
- Arg1産生腫瘍随伴マクロファージ(Arg1+ TAM)が産生するケモカインPF4ががん免疫を抑制するTh1-Tregの分化を誘導し、腫瘍の増殖につながっていることが判明
- PF4を中和することで、Th1-Tregの分化が阻害され、がん免疫を活性化し、かつ自己免疫を起こさずに、腫瘍の増殖を抑制できることを発見
- PF4を標的とする安全性の高い抗腫瘍免疫治療につながる可能性
概要
大阪大学大学院生命機能研究科大学院生の倉谷歩見さん、微生物病研究所の山本雅裕教授(免疫学フロンティア研究センター、感染症総合教育研究拠点、先端モダリティ・DDS 研究センター 兼任)らの研究グループは、腫瘍内のアルギナーゼ1 (Arg1)を産生するマクロファージ (Arg1+ TAM)が産生するケモカインPF4がTh1-Tregを誘導し、がん免疫を抑制することを明らかにしました。
これまで腫瘍内において強力にがん免疫を抑制するTregのサブセットの1つであるTh1-Tregが腫瘍内に高度に蓄積することが分かっていましたが、なぜそのようになるのか、その分子メカニズムは全く不明でした。今回、山本教授らのグループはArg1+ TAMを特異的に標識・除去可能な遺伝子改変マウスをVeDTRマウスシステムにより作製し、腫瘍随伴マクロファージの役割を検討しました。 担癌マウスでArg1+ TAMを除去したところ、腫瘍内Th1-Tregの割合の減少とがん免疫の強い活性化が確認されました。さらに、Arg1+ TAMが産生する液性因子PF4(別名CXCL4)がTregのTh1-Tregへの分化に関与することを明らかにしました。PF4欠損マウスや抗PF4中和抗体の投与によるPF4の機能の阻害によって、がん組織内Th1-Tregの割合の減少に伴うがん免疫の強い活性化が確認され、その結果、腫瘍増殖の抑制が確認されました(下図)。さらにPF4中和抗体の投与は、全Treg除去で起きる自己免疫になりませんでした。以上のことから、PF4が安全性の高い抗腫瘍免疫治療の新規標的となる可能性が大いに期待されます。
本研究成果は米国科学誌「Science」で、日本時間11月22日(金)午前4時にオンライン公開されました。
研究の背景
腫瘍組織では腫瘍細胞のほかに、免疫細胞、線維芽細胞、血管上皮細胞などが含まれており、腫瘍微小環境(TME)を形成しています。その構成細胞の1つである制御性 T 細胞 (Treg) はヘルパーT細胞 (CD4+ T 細胞) の亜集団(サブセット)であり、免疫恒常性の維持と自己免疫の抑制に重要な役割を果
たします。Tregの中でも、Th1型Treg (Th1-Treg) と呼ばれるサブセットは腫瘍組織に多く蓄積し、がん免疫を抑制します。Th1-Treg だけ除去する方法は、現在がんの免疫治療で用いられている全 Treg の除去(あるいは機能不全)でみられる自己免疫による副作用(免疫関連副作用)を引き起こしにくく安全であると考えられているため、有望ながん免疫療法のアプローチとして期待されています(参考:2023.7.14プレスリリース「Th1型制御性T細胞の除去は安全にがん免疫を誘導する」)。しかし、Th1-Treg が TME に大量に集積する分子メカニズムについてはほとんど解明されておらず、またTh1-Tregだけを除く方法も今のところ開発されていません。一方、マクロファージは自然免疫細胞の一種で病原体に対する宿主免疫応答に重要ですが、腫瘍内にも高度に蓄積することが分かっており、特に腫瘍内のマクロファージはTAM(腫瘍随伴マクロファージ)と呼ばれています。先行研究において、体内の全マクロファージの枯渇により TME の Treg が減少することが示されており、TME における Th1-Treg の高度な集積にマクロファージが関与している可能性が考えられます。そこで本研究ではマクロファージ全体ではなく、腫瘍内のマクロファージ、すなわち、TAMが腫瘍内のTh1-Tregの蓄積に関与するのかを正確に評価できる実験系を構築し、その分子メカニズムを明らかにすることを目的としました。
研究の内容
TAMは他の組織のマクロファージと比べてArg1という遺伝子の発現が高いことに着目し、2種類の遺伝子の発現で特徴づけられた任意の細胞集団を標識し除去できる新型マウスシステム(VeDTRマウス)を用いて、TAMを標的化した新規マウスを作製しました。具体的にはマクロファージ標識遺伝子であるCx3cr1とTAM標識遺伝子Arg1を組み合わせ、Cx3cr1-Cre/Arg1-Flp/VeDTRマウスを作製しました。このマウスを用いて、腫瘍を移植し、ジフテリア毒素によってArg1+TAMだけを選択的に除去した結果、腫瘍内のTh1-Tregの割合が低下し、さらにがん免疫が強く活性化しており、腫瘍の増殖が抑制されていました(図1)。
次に、Arg1+ TAM が TregのTh1-Treg への分化誘導に関与するか検討しました。その結果、Arg1+ TAMとの間接共培養群において、TregからTh1-Treg への分化が誘導されました(図2)。
図1. Arg1+ TAMの除去により腫瘍内のTh1-Tregが減少する
(A) Arg1+TAM除去群では対照群に比べ腫瘍内のTh1-Tregの割合が低下した。
(B) Arg1+TAM除去群では対照群に比べ抗腫瘍サイトカイン陽性CD4+T細胞の割合が増加した。
(C) Arg1+TAM除去群では対照群に比べ腫瘍の体積が小さかった。
図2. PF4刺激によりTh1-Tregが誘導される
(A) TregとArg1+TAMを共培養するとTreg中のTh1-Tregの割合が増加した。
(B) TregにPF4を処理し培養するとTh1-Tregの割合が増加した。
Th1-Treg 分化を誘導する Arg1+ TAM 由来の液性因子を解析したところ、Th1-Treg 分極を誘導する液性因子としてケモカインであるPF4 と呼ばれる分子を同定しました。
さらに生体内でのPF4の機能を調べるために、PF4欠損マウスを作製し、解析を行った結果、PF4欠損マウスの腫瘍組織では野生型に比べ腫瘍の増殖が抑制され、腫瘍内のTh1-Tregの割合が減少していました(図3)。
図3. PF4欠損マウスでは腫瘍内Th1-Tregの割合と腫瘍増大速度が減少する
(A) PF4欠損マウスでは野生型マウスに比べ腫瘍の体積が小さかった。
(B) PF4欠損マウスでは野生型マウスに比べ腫瘍内のTh1-Tregの割合が低下した。
図4. PF4中和抗体の投与により腫瘍内Th1-Tregの割合が減り、抗腫瘍免疫が活性化する
(A) PF4中和抗体投与群では対照群に比べ腫瘍内のTh1-Tregの割合が低下した。
(B) PF4中和抗体投与群では対照群に比べ抗腫瘍サイトカイン陽性CD4T細胞の割合が増加した。
(C) PF4中和抗体投与群では対照群に比べ腫瘍の体積が小さかった。
最後に、PF4の機能を阻害するPF4中和抗体(#6-1-5)を作製し、担癌マウスに投与した結果、腫瘍内のTh1-Tregの割合の低下とがん免疫の強い活性化が起き、腫瘍の増殖が抑制されました(図4)。
さらにPF4中和抗体の投与によって自己免疫が起きるかを検討した結果、全Tregの除去によって起きるような免疫細胞の活性化やそれに伴う体重減少なども全く起きず、高い安全性が示唆されました。さらにPF4中和抗体の薬効は全Tregの除去(または機能不全)を起こす抗CTLA4抗体投与と同等でした(図5)。
以上よりArg1+ TAMより産生される液性因子PF4は腫瘍内においてTh1-Tregを誘導し、がん免疫を抑制することにより腫瘍の増殖を促進することが明らかになりました。そしてPF4の阻害はTh1-Tregの分化を阻害し、自己免疫を起こすことなく安全かつ全Treg除去と同等に腫瘍の増殖を抑制できることが分かりました。
図5. PF4中和抗体を投与しても、全Treg除去のような自己免疫にならない
(A) PF4中和抗体投与群では対照群と比べ体重減少はみられなかった。一方、全Tregを除去すると著しい体重減少が起きた。
(B) 脾臓内において、全Treg除去群では活性化T細胞(CD62L低発現T細胞)がCD8+T細胞において大きく上昇(活性化)しており自己免疫状態になっていたが、PF4中和抗体投与群では対照群と差がなかった。
(C) PF4中和抗体投与群と抗CTLA4抗体投与群で腫瘍の成長は同程度に抑制された。
本研究成果が社会に与える影響(本研究成果の意義)
本研究によりPF4の阻害はがん免疫を活性化し、腫瘍の増殖が抑制されることが明らかとなりました。TCGAデータベースによると腫瘍内のPF4の高発現やマクロファージの高度な蓄積は予後不良と相関があることを示しています(図6)。そのためPF4は自己免疫になることなく抗腫瘍免疫治療ができる新規創薬標的となることが大いに期待されます。
図6. ヒト腫瘍におけるPF4とCD11bの高発現は予後不良を示す
(A) TCGAデータベースを用いて作成したPan-Cancer(汎がん)のPF4 の高発現患者群と低発現患者群の生存曲線。
(B) PF4とマクロファージマーカー遺伝子CD11b (ITGAM) の高発現と低発現との組み合わせを示す。PF4高発現かつCD11b高発現の群が最も生存確率が低い。
特記事項
本研究成果は、2024年11月22日(金)午前4時(日本時間)に米国科学誌「Science」(オンライン)に掲載されました。
タイトル:“Platelet factor 4-induced Th1-Treg polarization suppresses anti-tumor immunity”
著者名:Ayumi Kuratani, Masaaki Okamoto, Kazuki Kishida, Daisuke Okuzaki, Miwa Sasai, Shimon Sakaguchi, Hisashi Arase, Masahiro Yamamoto
DOI: 10.1126/science.adn8608
なお、本研究は、JST創発的研究支援事業(FOREST)「次世代型免疫細胞サブセット解析手法の開発とその実装」(グラント番号:JPMJFR206D)、 ワクチン開発のための世界トップレベル研究開発拠点群 大阪大学シナジーキャンパス(大阪大学ワクチン開発拠点)(グラント番号:JP223fa627002) の一環として行われました。
参考URL
大阪大学微生物病研究所 感染病態分野(山本研)
https://immpara.biken.osaka-u.ac.jp/
山本雅裕教授 研究者総覧
https://rd.iai.osaka-u.ac.jp/ja/0b3a8cfc76bb6001.html
用語説明
- Arg1
アルギナーゼ1。L-アルギニンをL-オルニチンと尿素に加水分解する酵素。増殖しているリンパ球やがん細胞において高い活性を示す。
- 腫瘍随伴マクロファージ
腫瘍組織内に浸潤・集積しているマクロファージ(Tumor-associated macrophage, TAM)。大部分は腫瘍に対する免疫応答を抑制し、腫瘍の増殖の促進に関与することが報告されている。
- Th1-Treg
制御性T細胞(Treg細胞)はヘルパーT細胞の一種であり、免疫応答を抑える機能を持ち、免疫恒常性の維持と自己免疫の抑制に重要な役割を果たす細胞である。転写因子Foxp3を特異的に発現する。
腫瘍内に浸潤するTregはさらにT-betも発現することがあり、Th1 型 Treg (Th1-Treg)と呼ばれており、Th1依存的な免疫応答(腫瘍においては抗腫瘍免疫)を特異的に抑制することを、昨年、山本研究室は報告した。(参考:2023.7.14プレスリリース「Th1型制御性T細胞の除去は安全にがん免疫を誘導する」)。
- VeDTRマウス
昨年、山本研究室が上記論文で開発を報告した新型マウス。VeDTRマウスの中では、Cre-loxPシステムとFlp-FRTシステムという2つの部位特異的リコンビナーゼを組合せ、2種類の遺伝子の発現で特徴づけられた任意の細胞集団において蛍光タンパク質およびヒト型のジフテリアトキシン受容体(DTR)を発現できる。ジフテリアトキシンはヒトやサルには毒性が強いが、マウスでは毒性が低いという特徴を持つ。したがって、VeDTRマウス内でジフテリアトキシンがヒト型DTRに作用すると、特定の細胞だけが除去される。
- 免疫関連副作用
irAE(immune-related Adverse Effect)とも呼ばれる。免疫チェックポイント阻害剤として使われている抗CTLA4抗体(イピリムマブ)では、全Tregに作用し、その結果起きる免疫系の過剰活性化によって、内分泌障害、間質性肺疾患、消化器系障害、神経系の障害、肝機能障害など、さまざまな種類の副作用が報告されている。
- TCGAデータベース
TCGA (The Cancer Genome Atlas) は、米国がん研究所と米国ヒトゲノム研究所が共同で作ったデータベースである。33種類のがん種で、11,000人以上のがん患者に由来するがんサンプルを使って、ゲノム変異/遺伝子発現変動/メチル化異常など7種類のデータタイプを網羅的に解析しており、がん研究に幅広く活用されている。
