データサイエンスで寄生虫の病原性因子を丸裸に!
多種多彩な新規トキソプラズマ症創薬戦略につながる研究成果
研究成果のポイント
- トキソプラズマ原虫の生体内CRISPRスクリーニング法を開発、病原性因子を短期間かつ網羅的に同定することが可能に。
- 宿主遺伝学改変技術と組み合わせることにより、宿主免疫を抑制する病原性因子だけを選別
- データサイエンスが研究を飛躍的に加速させ、トキソプラズマ症の新規治療薬開発に期待
概要
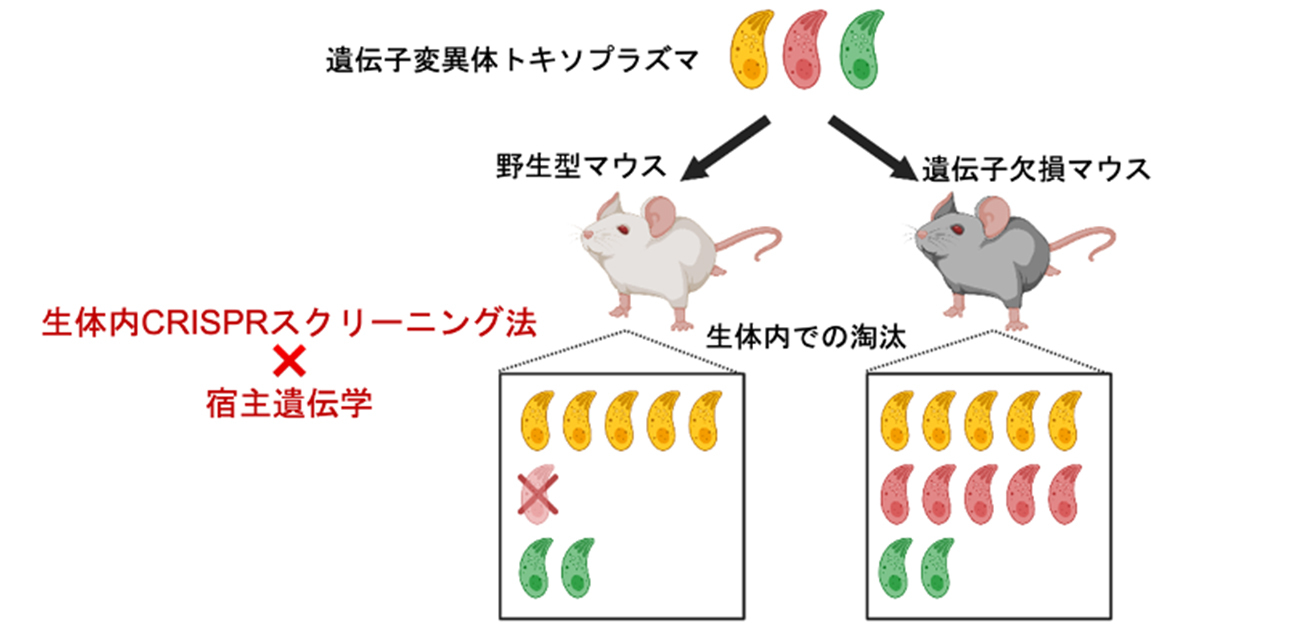
大阪大学大学院医学系研究科の大学院生の橘優汰さん(博士後期課程)、同微生物病研究所 山本雅裕教授(免疫学フロンティア研究センター、感染症総合教育研究拠点兼任)らの研究グループは、データサイエンスを駆使することで、病原性寄生虫「トキソプラズマ原虫」の病原性に関与する遺伝子を宿主生体内で網羅的に探索できる次世代技術(生体内CRISPRスクリーニング法)を開発し、トキソプラズマ原虫の決定的な病原性因子を多数同定しました。さらに宿主遺伝学改変技術と併用することで、生体内における病原体と宿主の免疫学的な相互作用を網羅的かつ選択的に解析可能であることを世界で初めて証明しました(図1)。
トキソプラズマ原虫は新生児や免疫不全状態のヒトで重篤なトキソプラズマ症を引き起こす重要な病原性寄生虫で、世界人口の3分の1が感染していると考えられています。トキソプラズマ原虫は8000個以上の遺伝子を有していますが、そのうちのどれだけがトキソプラズマ症という病気を引き起こすのに重要な病原性因子であるかは謎に包まれていました。そのためトキソプラズマ症の病態解明は十分には進んでいないのが現状です。また、これまでの研究ではたとえ新規の病原性因子を同定したとしても、その病原性因子が標的としている我々宿主側の因子を同定することは非常に大きな困難を伴いました。このことはトキソプラズマ症に対する治療薬やワクチンの開発に大きな障壁となっていました。
本研究が確立したデータサイエンスを駆使する新技術を用いることで、トキソプラズマ症の病態解明、ひいては新規治療薬やワクチンの開発が加速することが大いに期待されます。
本研究成果は、米国科学誌「Cell Reports」に6月1日(木)にオンライン公開されました。
図1. 生体内CRISPRスクリーニング法と宿主遺伝学の併用による宿主・病原体相互作用の網羅的解析
研究の背景
トキソプラズマ原虫は全世界人口の3分の1が感染していると考えられる寄生虫で、ネコの糞や汚染された生肉などから感染することで新生児や免疫不全患者に重篤なトキソプラズマ症を引き起こします。我が国においても毎年感染者が報告されており、臨床上・公衆衛生上の大きな問題となっています。これまでトキソプラズマ原虫の病原性研究は順遺伝学と逆遺伝学と呼ばれる古典的な方法で行われきました。しかしそれらの従来法では8000個以上の機能未知の遺伝子を有するトキソプラズマの病原性機構の解明はいくら時間があっても終わりません。近年、米国や英国のグループによって、遺伝子改変技術であるCRISPR(クリスパー)/Cas9ゲノム編集を応用し、順遺伝学と逆遺伝学を組み合わせたCRISPR遺伝学に基づくCRISPRスクリーニング法という革命的な新技術が開発され、in vitro(試験管内)とin vivo(生体内)におけるトキソプラズマ原虫の遺伝子の解析が行われてきました。しかし、高病原性トキソプラズマ原虫をマウス生体内で網羅的に解析することは非常に技術的障壁が高く、低病原性原虫を用いてごく限られた一部の遺伝子群(約200遺伝子)でのみ生体内スクリーニング法は試みられてきました。
研究の内容
研究グループでは、通常用いられる全身感染モデルではなく、局所感染モデルを採用することで病原性の問題を克服し、1000個以上のトキソプラズマ原虫の遺伝子を生体内でスクリーニングしました。この新型の生体内CRISPRスクリーニング法では数千種類の遺伝子変異体を一度にまとめて作製・解析できます。変異体集団のゲノムDNAを次世代シーケンスによって解読し、その膨大なデータをプログラミングと統計で解析するデータサイエンスを駆使して、感染の前後で消失した遺伝子(すなわち病原性に重要な遺伝子)を同定することが可能です(図2)。この結果、これまで世界中の研究者が20年以上をかけて一つずつ同定してきた既知の病原性因子群を、わずか1ヶ月間で根こそぎ検出することができました(図3)。さらに、これまでに見落とされてきた新規病原性因子GRA72を含め、多数の未報告の病原性因子を発見しました。GRA72遺伝子を欠損するトキソプラズマ原虫を作製したところ病原性が完全に消失したことから、このスクリーニング結果の高い信頼性が確認されました。また、このGRA72に関しては詳細な解析を行い、寄生胞と呼ばれるトキソプラズマ原虫が作り出す構造物の維持に関与することを突き止めました。
次に抗トキソプラズマ原虫免疫に最も重要な宿主免疫因子として知られているインターフェロンγを欠損した遺伝子改変マウスを用いて、生体内CRISPRスクリーニング法を行いました(図1)。その結果、トキソプラズマ原虫が宿主のインターフェロンγ依存的免疫応答を抑制するために持っている4つの代表的病原性因子を特異的に検出することに成功しました(図4)。この結果から、病原体と宿主の遺伝学を組み合わせることで、生体内における宿主・病原体相互作用が網羅的に解析可能であることが世界で初めて実証されました。さらにこれまで知られていなかった多数の抗インターフェロンγ病原性因子を同定することにも成功しました。
本研究で同定した新規病原性因子には、これまでに世界中で研究されていた病原体から放出される『分泌型』タンパク質のみならず、まだほとんどの研究者が注目していない、病原体から放出されない『非分泌型』タンパク質が多数含まれていました。このことが示唆するのは、これまでの我々のトキソプラズマ原虫の病原性因子への理解はごく限られた狭い範囲の話であって、実際の病原性因子の全容はより複雑でまだまだ未解明であるということです。今後、この新技術を駆使してトキソプラズマ病原性因子の全体像が解明されていくと考えられます。
図2. 生体内CRISPRスクリーニング法の概要
図3. 実際の生体内CRISPRスクリーニング法の結果
図4. インターフェロンγと関連する病原性因子の抽出
本研究成果が社会に与える影響(本研究成果の意義)
本研究成果により、従来と比較にならない短期間でトキソプラズマ原虫の病原性因子をまとめて同定・解析することが可能となります。トキソプラズマ原虫は一度感染すると、完全に排除することは不可能で一生涯に渡って感染し続けますが、本研究で同定された多数の病原性因子はトキソプラズマ原虫の『弱点』であり、それらを標的とした様々な新規治療法やワクチンの開発が大いに期待されます。
特記事項
本研究成果は、米国科学誌「Cell Reports」に6月1日(木)にオンライン公開されました。
タイトル:“Host genetics highlights IFN-γ-dependent Toxoplasma genes encoding secreted and non-secreted virulence factors in in vivo CRISPR screens”
著者名:Yuta Tachibana, Emi Hashizaki, Miwa Sasai and Masahiro Yamamoto
DOI:https://doi.org/10.1016/j.celrep.2023.112592
なお、本研究は、AMED 新興・再興感染症に対する革新的医薬品等開発推進研究事業 令和2-4年度「日本のトキソプラズマ症の感染実態把握とその制御に向けた協創的研究開発」 および 令和5年度 「日本のトキソプラズマとクリプトスポリジウムが起こすヒト胞子虫類原虫症の病態理解・感染実態把握・制御に向けた総合的研究開発」、さらに、「日本財団・大阪大学 感染症対策プロジェクト」における[オール阪大研究プロジェクト]の一環として行われました。
参考URL
大阪大学微生物病研究所 感染病態分野(山本研)
https://immpara.biken.osaka-u.ac.jp/
用語説明
- トキソプラズマ原虫
ネコ科動物を終宿主とする寄生虫で、ヒトを含め全ての恒温動物に感染可能。初感染の妊婦の場合、胎児や新生児に重篤な障害・奇形をもたらす原因となる。既感染で免疫不全となると致死的な脳炎や肺炎、心筋炎を起こすこともある。また、最近の研究ではトキソプラズマに感染すると性格や行動が変わるという報告もある。
- 生体内CRISPRスクリーニング法
従来のCRISPRスクリーニング法を生体に応用することで、病原体が宿主の体内で生存するのに必要な遺伝子を探索することができる。順遺伝学と逆遺伝学の両者の利点を兼ね備えた次世代型遺伝学である「CRISPR遺伝学」に基づく次世代型の解析手法。
- 順遺伝学
観察された表現型を元に、原因となる遺伝子を同定する方法。最も古典的な遺伝学的解析方法。
- 逆遺伝学
特定の遺伝子にまず注目し、その遺伝子の機能を抑制または亢進させる際に生じた表現型から遺伝子機能を解析する遺伝学的方法。
- CRISPR(クリスパー)/Cas9
ゲノムDNAを切断し、遺伝子情報を自由に書き換えることができる技術。現在は臨床応用も進み治療にも役立てられている。元々は細菌や古細菌の生体防御システムであった。2020年にノーベル化学賞を受賞。
- 次世代シーケンス
DNA配列を高速かつ大量に決定する技術。遺伝子の情報を取得することができる。
- 寄生胞
トキソプラズマ原虫やマラリア原虫が宿主細胞内で作り出す膜構造物。この寄生胞がシェルターのような役割を果たすことでこれらの病原体は宿主免疫による攻撃から守られている。
- インターフェロンγ
サイトカインの一種。免疫系を活性化し、細胞内寄生性病原体に対する生体防御を司っている。
