寄生虫感染により産生誘導される一酸化窒素が宿主免疫に悪影響
トキソプラズマ病原性因子GRA15による新規「ヒト」免疫抑制機構の解明
研究成果のポイント
・マウスの研究では機能解明されていなかったトキソプラズマ病原性因子GRA15 が、ヒトでは免疫応答を抑制するという新規の病原性機構を発見
・GRA15は宿主細胞に作用して一酸化窒素 の産生を誘導し、免疫反応を抑制していることを明らかに
・一酸化窒素合成阻害剤が「ヒト」のトキソプラズマ症の新しい治療薬となることが期待される
概要
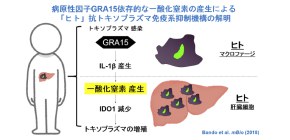
大阪大学微生物病研究所の山本雅裕教授(免疫学フロンティア研究センター兼任)らの研究グループは、トキソプラズマの病原性因子GRA15によって、宿主免疫系が強制的に活性化され一酸化窒素(NO)を産生させられることで、ヒトの抗トキソプラズマ免疫を抑制することを世界で初めて明らかにしました。
これまでマウスの研究では、病原性因子GRA15は宿主免疫系を活性化することは知られていましたが、トキソプラズマによって本来不利であるはずの宿主免疫活性化がなぜ起こるのか、その理由は不明でした。
今回、山本教授らの研究グループは、
①ヒト肝臓細胞では、GRA15依存的にマクロファージから放出されたインターロイキン1(IL-1) により、一酸化窒素(NO)産生が誘導されること
②トキソプラズマのGRA15により誘導された一酸化窒素(NO)が、ヒトの抗トキソプラズマ免疫反応に重要なIDO1 を減少させることによって、ヒトの免疫反応を抑制すること
を発見しました。これにより、一酸化窒素(NO)の産生阻害が「ヒト」のトキソプラズマ症の新しい治療戦略となることが期待されます。
本研究成果は、米国科学誌「mBio」に、10月9日(火)午後7時(日本時間)に公開されました。
研究の背景
トキソプラズマはヒトを含む全ての恒温動物に感染する人畜共通の寄生虫です。世界人口の3分の1が感染していると言われますが、免疫系が正常である場合は特に問題はありません。しかしトキソプラズマは、エイズにかかる、臓器移植を受けるなどの免疫不全状態になると致死的な脳炎や肺炎、肝炎などを引き起こしたり、妊婦が初感染すると流産や新生児が先天性の水頭症や眼の疾患を引き起こす病原体で、現在、トキソプラズマ症は我が国で医学的に最も大きな問題となっている寄生虫疾患のひとつであると言っても過言ではありません。
トキソプラズマは細胞に感染してのみ増殖ができる寄生虫です。これまでに宿主の細胞に感染した際に様々な分子を放出することが知られており、日欧米中の間でそれら分子がどのように病原性発症にかかわってくるのかなど、その寄生虫学の研究競争が激化しています。その中の一つであるGRA15も宿主細胞内に放出され、宿主免疫系を活性化することが知られていました。しかし、マウスを使った寄生虫免疫学による研究の結果、GRA15を欠損したトキソプラズマの方が野生型原虫よりも病原性が増す(つまり、GRA15が無い方がトキソプラズマには有利である)ことが報告され、トキソプラズマがGRA15を持つ寄生虫学上の意義は長い間不明でした。
研究内容の詳細
山本教授らの研究グループでは、インターフェロン 依存的な抗トキソプラズマ免疫応答がヒトとマウスで大きく異なる点に着目し、研究を進めました。その結果、GRA15は、ヒトでは抗トキソプラズマ免疫応答を抑制するという新規の病原性機構を発見しました。
まず、ヒトのマクロファージや肝臓細胞の単独培養系に、野生型トキソプラズマまたはGRA15欠損トキソプラズマを感染させたところ、GRA15の有無にかかわらずトキソプラズマはインターフェロン刺激によって増殖が抑制され、両者の間に違いを見つけることはできませんでした (図1A) 。トキソプラズマが感染した宿主の体内では、トキソプラズマに感染したマクロファージが様々な臓器を巡ります。このことから、肝臓細胞とトキソプラズマに感染したマクロファージを一緒に培養する系(共培養系)で試験してみました。その結果、野生型のトキソプラズマに比べてGRA15を欠損したトキソプラズマは、インターフェロン存在下で増殖できないことがわかりました (図1B) 。
その理由を詳細に解析した結果、まず感染マクロファージはトキソプラズマのGRA15依存的にインターロイキン(IL1)と呼ばれるサイトカインを産生し、放出することがわかりました (図2A) 。そこでIL-1を肝臓細胞に作用させたところインターフェロンと相乗的に働き、肝臓細胞においてNOを合成する酵素の一つである誘導型一酸化窒素合成酵素(iNOS)の発現が上昇、NOの合成が誘導されていました。さらにこのNOが、ヒトにおいて抗トキソプラズマ免疫応答に必須の役割をしているIDO1のタンパク質量が著しく減少させ、免疫応答を抑制していることがわかりました。
これらの結果により、トキソプラズマがGRA15依存的にインターフェロン誘導性の抗トキソプラズマ免疫反応を抑制していることが明らかになりました (図2B,C) 。これは、元来マウスの寄生虫免疫学で重要な抗トキソプラズマ宿主因子と考えられていたNOが、ヒトでは逆に抗トキソプラズマ免疫反応を抑制していたという点でとても意外でした。さらに、iNOSの阻害剤を加えることによって、GRA15を有する野生型トキソプラズマの増殖をマクロファージ・肝臓細胞の共培養系でも抑制できることを確認しました (図2D) 。
以上の結果から、ヒトの抗トキソプラズマ免疫反応の抑制におけるNOの重要な役割が明らかとなりました (図3) 。
参考図

図1 GRA15依存的な抗トキソラズマ免疫応答抑制
(A)未刺激またはインターフェロンで刺激したヒトのマクロファージまたはヒトの肝臓細胞に野生型またはGRA15欠損トキソプラズマを感染させた後に原虫数を比較した結果、どちらのトキソプラズマも数が同様に低下していた。
(B)野生型またはGRA15欠損トキソプラズマを感染させたヒトマクロファージをヒト肝臓細胞と共培養し、インターフェロン刺激したところ、野生型トキソプラズマに比べてGRA15欠損トキソプラズマ感染群は数が低下していた。このことから、ヒトマクロファージと肝臓細胞の共培養系で、GRA15によるインターフェロン依存的な抗原虫応答の抑制が観測された。

図2 GRA15依存的な一酸化窒素の産生と一酸化窒素産生阻害による野生型トキソプラズマの増殖抑制
(A)野生型トキソプラズマを感染させたマクロファージからIL-1が産生される。一方、GRA15欠損トキソプラズマ感染細胞から全くIL-1が産生されない。
(B)野生型またはGRA15欠損トキソプラズマを感染させたヒトマクロファージをヒト肝臓細胞と共培養し、インターフェロン刺激したところ、野生型トキソプラズマに比べてGRA15欠損トキソプラズマ感染群は一酸化窒素が全く産生されていなかった。
(C)(B)の条件で、iNOS及びIDO1タンパク質を検出したところ、iNOSについては野生型トキソプラズマ感染群では検出されたが、GRA15欠損トキソプラズマ感染群ではiNOSが全く検出されなかった。一方IDO1について、野生型トキソプラズマ感染群ではほとんど検出されず、GRA15欠損トキソプラズマ感染群ではIDO1が多く発現していた。
(D)一酸化窒素合成阻害剤(既に糖尿病合併症治療薬として広く使われている化合物)存在下で、野生型トキソプラズマ感染群であってもインターフェロン刺激後の数が大幅に減少した。
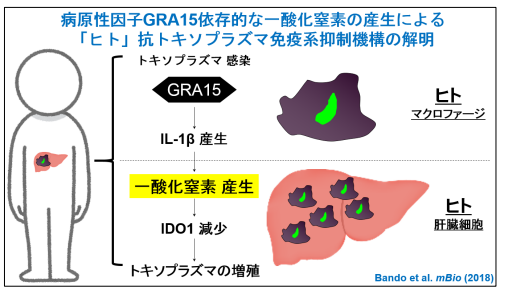
図3 GRA15によるインターフェロン誘導性「ヒト」抗トキソプラズマ免疫系抑制機構
トキソプラズマ感染によって、GRA15依存的にヒトマクロファージからIL-1が産生され、それが肝臓細胞にインターフェロンと共に作用すると一酸化窒素の産生が起きる。その結果、インターフェロン刺激により誘導されるはずのヒト抗トキソプラズマ免疫分子であるIDO1が減少し、トキソプラズマは増殖できる
本研究成果が社会に与える影響(本研究成果の意義)
本研究成果により、トキソプラズマ感染時に起きるNOの産生を阻害すれば、トキソプラズマによる免疫抑制作用を回避できることを示唆しており、「ヒト」トキソプラズマ症の新規の治療戦略を提供できるものと期待されます。
特記事項
本研究成果は、2018年10月9日(火)午後7時(日本時間)に米国科学誌「mBio」(オンライン)に掲載されました。
タイトル:“Inducible Nitric Oxide Synthase Is a Key Host Factor for Toxoplasma GRA15-Dependent Disruption ofthe Gamma Interferon-Induced Antiparasitic Human Response”
著者名:Hironori Bando, Youngae Lee, Naoya Sakaguchi, Ariel Pradipta, Ji Su Ma, Shun Tanaka, Yihong Cai, JianfaLiu, Jilong Shen, Yoshifumi Nishikawa, Miwa Sasai, and Masahiro Yamamoto
なお、本研究は、日本医療研究開発機構(AMED)新興・再興感染症に対する革新的医薬品等開発推進研究事業「トキソプラズマ症の総合的対策に向けた開発研究」の一環として行われ、帯広畜産大学原虫病研究センター西川義文教授の協力を得て行われました。また、感染症研究革新イニシアティブ(J-PRIDE)「新規治療戦略基盤創出に資する病原性原虫のPCV破壊・形成・維持に関与する宿主因子群の解明」の研究支援を受けて実施されました。
参考URL
大阪大学 微生物病研究所 感染病態分野
http://www.biken.osaka-u.ac.jp/lab/immpara/
用語説明
- GRA15
GRA15(グラ15)
トキソプラズマのデンスグラニュール(濃縮顆粒)から宿主細胞に放出されるタンパク質の一つ。2011年に宿主免疫系を強く活性化することが米国・マサチューセッツ工科大の研究グループにより報告されましたが、マウスを使った実験系ではGRA15欠損トキソプラズマはむしろ病原性が増してしまい、GRA15がトキソプラズマに何のために存在しているのか意義を示せませんでした。その後も欧米グループからGRA15に関する論文が複数出ましたが、全て宿主免疫系の活性化について述べるにとどまり、GRA15のトキソプラズマにとっての利点(存在意義)はいよいよ不明なままでした。
- 一酸化窒素
一酸化窒素(Nitric Oxide=NO)
インターフェロン刺激によって、誘導型一酸化窒素合成酵素(iNOS)が誘導される結果、一酸化窒素が合成されます。マウスではインターフェロン刺激によってマクロファージを含め、様々な細胞から一酸化窒素が高濃度に産生され、慢性期のトキソプラズマ症の発症抑制に重要です。一方、ヒトにおいてはインターフェロン刺激によって一酸化窒素が産生される細胞は限られており、その濃度もマウス細胞に比べて10倍程度低くなります。またヒトのマクロファージからは一酸化窒素はほとんど産生されません。 のIDO1と同様に、インターフェロンによる一酸化窒素の産生もヒトとマウスでは大きく異なっています。
- インターロイキン1(IL-1)
炎症性サイトカインの一つ。GRA15がマクロファージ内で細胞内シグナル伝達経路を活性化した結果、マクロファージから放出されます。
- IDO1
インターフェロンによって発現が誘導されるトリプトファン分解酵素。トリプトファンはトキソプラズマが細胞内で増殖するのに必須のアミノ酸ですが、インターフェロン刺激によって誘導されたIDO1により急速に分解されるため、トリプトファンが欠乏しトキソプラズマの増殖が阻害されます。これはヒト細胞では観測されますが、マウスの細胞では観測できないことから、このIDO1に依存した抗トキソプラズマ応答が、ヒトとマウスで異なっていることを、2018年9月に山本教授らのグループが報告しました(Bando et al. Frontiers in Immunology,2018年)。
- インターフェロン
サイトカインの一つ。本研究でのインターフェロンはインターフェロンガンマのことです。インターフェロンガンマはヒトとマウスの両方で、抗トキソプラズマ免疫応答に必須の役割を果たします。
