排水を資源化する光触媒技術 太陽光で硝酸排水からアンモニアを合成
常温・常圧下、鉄さび触媒で実現
研究成果のポイント
概要
大阪大学大学院基礎工学研究科 化学工学領域/附属太陽エネルギー化学研究センターの白石 康浩准教授、大学院生の秋山翔太郎さん(博士前期課程2年)、平井 隆之教授らの研究グループは、太陽光照射下、NO3–排水を原料としてNH3を合成する光触媒技術を開発しました。
NH3は、化学肥料の原料として重要な化学物質であるほか、近年では、再生可能エネルギーの貯蔵・輸送を担うエネルギーキャリアとしても注目されています。しかし従来のNH3合成は、非常に高い水素圧力・温度下でN2を反応させる(N2 + 3H2⇄2NH3)方法により行われています。一方、NO3–は工業排水に多量に含まれる環境汚染物質です。強酸性排水であるため、従来は、中和した後、微生物などによりN2へ還元することで無害化して環境中に排出されています。したがって、再生可能エネルギーを用いて、排水中のNO3–をNH3に変換することができれば、排水の無害化・再資源化とともに、窒素資源循環を行うための新たな技術となります。
光触媒反応では、太陽光エネルギーにより水を還元剤としてNO3–からNH3を製造する(HNO3 + H2O → NH3 + 2O2)ことが原理的には可能です。しかし、通常の光触媒では、水の四電子酸化(2H2O → O2 + 4H+ + 4e–)と、NO3-の八電子還元(NO3- + 9H+ + 8e- → NH3 + 3H2O)を進めることは難しく、これまで本反応を進める反応系は開発されていませんでした。
研究グループでは、天然に存在する鉄さびの一種であるβ-オキシ水酸化鉄(β-FeOOH(Cl))に表面酸素欠陥(OVs)を形成させたβ-FeOOH(Cl)-OVsを光触媒として用いました。本触媒粉末を、塩化物イオン(Cl–)とともにNO3–排水に加えて太陽光を照射することにより、水を還元剤としてほぼ100 %の選択率でNO3–をNH3に変換する光触媒技術を開発しました。
本研究成果は、米国化学誌「JACS Au」に、4月2日(火)17時(日本時間)に公開されました。
研究の背景
NH3は化学肥料の原料として重要な化学物質であり、世界の食糧生産の根幹を担っています。また、NH3は近年、再生可能エネルギーの貯蔵・輸送を担うエネルギーキャリアとしても注目されています。しかし、従来の工業プロセス(ハーバー・ボッシュ法)によるNH3合成では、H2とN2を非常に高い温度と圧力下(450 °C以上、200気圧以上)で反応させる必要がありました。
NO3–は工業排水に多量に含まれる環境汚染物質です。強酸性排水であるため、従来は、中和した後、微生物などによりN2へ還元することにより無害化して環境中に排出されています。すなわち、窒素資源を無駄なく循環利用するには、NO3–を有用資源に変換する必要があります。したがって、再生可能エネルギーを用いて排水中のNO3–をNH3に変換できれば、排水の無害化・再資源化を行うとともに、新たなNH3合成技術となります。
光触媒反応では、太陽光エネルギーにより水とNO3–からNH3を製造する(HNO3 + H2O → NH3 + 2O2)ことが原理的には可能です。この反応を進行させるためには、光励起により生成したホールによる水の四電子酸化(2H2O → O2 + 4H+ + 4e–)と、励起電子によるNO3-の八電子還元(NO3- + 9H+ + 8e- → NH3 + 3H2O)を進める必要があります。しかし、これらの多電子反応を進めることは難しく、これまで本反応を進める反応系は開発されていませんでした。
研究の内容
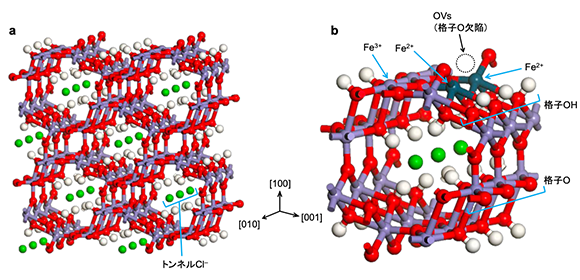
研究グループではこれまで、光触媒によるNH3合成に注目した技術開発を進めてきました。そして今回、天然に存在する典型的な鉄の腐食物であるβ-オキシ水酸化鉄(β-FeOOH(Cl))に注目しました。β-FeOOH(Cl)は、図1(a)に示すように、FeO3(OH)3八面体から構成されるトンネルサイトを有する中空型結晶であり, 電荷を中和するため、トンネル内に塩化物イオン(Cl-)を内包した構造をもっており、「塩化物イオン内包型鉄さび」と呼ばれます。本研究では、図1(b)に示すように、表面酸素欠陥(OVs)を形成させたβ-FeOOH(Cl)-OVs触媒を、NO3–とCl-を含む溶液に懸濁させて光照射を行うことにより、水を還元剤としてほぼ100 %の選択率でNO3–をNH3に変換できることを見出しました。
図1. 本技術で用いるβ-FeOOH(ClT)-OVs触媒の構造
(a)骨格構造、(b)表面構造
図2に示すように、HNO3およびKClを含む強酸性水溶液(pH ~1)にβ-FeOOH(Cl)-OVs触媒を懸濁させて疑似太陽光を照射すると、NH3濃度は照射時間に対して直線的に増加します。長時間(96時間)の反応を行った場合にもNO3–反応量に対するNH3生成量の選択率はほぼ100%を維持しており、NO3–を選択的かつ安定的にNH3に還元できることが分かります。また、O2とNH3の生成量の比は2:1であり、両論式(HNO3 + H2O → NH3 + 2O2)どおり、水を還元剤としてNO3–をNH3に変換できることが分かります。したがって、強酸性NO3– 排水を中和することなく、Cl-とβ-FeOOH(Cl)-OVs触媒を加えて太陽光を照射する簡便な操作により、安定的にNH3を製造できることを実証しました。
図2. HNO3 (800 μM)とKCl (550 mM)を含む水 (pH ~1) に疑似太陽光を照射した場合の時間とNH3生成量・NH3選択率の関係
NH3は光照射にともない継続的に生成し、長時間反応後もほぼ100%の選択率を維持する。
図3は、β-FeOOH(Cl)-OVs触媒上での反応メカニズムを示しています。触媒は光を吸収して、ホール(h+)と励起電子(e–)を生成します。図3(内側)に示すように、ホールは自身のトンネルCl-を酸化してCl2を生成します(2Cl– → Cl2 + 2e–)。トンネルCl–は骨格と強く相互作用しているため、溶液中のCl–よりも酸化されやすく、この反応は効率よく進みます。この際、失われたトンネルCl-は溶液から補填されます。生成したCl2はすぐに水分子との不均化して次亜塩素酸(HClO)を生成します(Cl2 + H2O ⇌ HClO + H+ + Cl–)。HClOは光を吸収して分解(2HClO → O2 + 2H+ + 2Cl–)し、O2を生成します。これらの、Cl-の自己酸化、Cl-の補填、HClOの光分解が進行することにより、系全体としては水を還元剤としてホールを消費します(2H2O → O2 + 4H+ + 4e–)。
一方、図3(外側)に示すように、NO3–の還元はOVs(i)上で進行します。NO3–は橋掛構造でOVsに吸着し(ii)、励起電子によるN–O開裂(iii)、水の脱離によりNO2–中間体(iv)を生成します。続くN–O開裂(v)、水の脱離によりNO中間体(vi)を生成します。さらなるN–O開裂(vii)と水の脱離によるアミン中間体(viii)の生成、続く還元(ix)とプロトン化により生成したNH3(x)が脱離することによりOVsを再生します。これらのメカニズムは、密度半関数(DFT)法を用いる計算化学によっても支持され、水を還元剤として触媒的にNH3が生成することを突き止めました。
図3. 本光触媒系におけるNH3生成メカニズム
(内側)Cl–の自己酸化、補填、HClOの光分解から成る水を還元剤とするホール消費メカニズム
(外側)OVsを活性点とするNO3– の還元メカニズム
本研究成果が社会に与える影響(本研究成果の意義)
本研究成果により、太陽光エネルギーにより、NO3– 排水を原料として、安価な鉄さび触媒とCl-を使ってNH3を効率よく合成できることが明らかになりました。本方針にもとづけば、排水からNH3を合成することが可能となり、排水の無害化と再資源化を行う社会実装が期待できます。
特記事項
本研究成果は、米国化学誌「JACS Au」に、4月2日(火)17時(日本時間)に公開されました。
タイトル:“Sunlight-Driven Nitrate-to-Ammonia Reduction with Water by Iron Oxyhydroxide Photocatalysts”
著者名:Yasuhiro Shiraishi, Shotaro Akiyama, Wataru Hiramatsu, Kazutoshi Adachi, Satoshi Ichikawa, and Takayuki Hirai
DOI: 10.1021/jacsau.4c00054
なお、本研究は、科学研究費助成事業(基盤研究B)「塩水と空気から次亜塩素酸を合成する金属ナノ粒子/半導体相界面光触媒」(研究代表者:平井隆之 大阪大学大学院基礎工学研究科 附属太陽エネルギー化学研究センター)の支援により実施されました。
参考URL
白石康浩 准教授 研究者総覧URL
https://rd.iai.osaka-u.ac.jp/ja/f7482bda1ee072b7.htm
SDGsの目標
用語説明
- エネルギーキャリア
エネルギーの輸送・貯蔵のための化学物質。特に、アンモニアや有機ハイドライド、ギ酸、H2O2など、海外など再生可能エネルギーが豊富な地域で得た電気エネルギーを化学的に変換して消費地まで貯蔵・輸送するのに用いられる化学物質を指す。
- 光触媒
光を吸収することにより生ずる正孔と電子により、それぞれ酸化・還元作用を示す物質。代表的な光触媒として、二酸化チタン(TiO2)が知られている。


