SARS-CoV-2スパイク蛋白質受容体結合ドメインがヒトiPS細胞由来分化心筋細胞に与える影響を解明
COVID-19ワクチン後の心筋炎について機序解明の一助に
研究成果のポイント
- 新型コロナウイルス感染症(COVID-19)に対するmRNAワクチン接種後に、心筋炎の発症リスクが増加することが報告されているが、そのメカニズムは未だ解明されていない。
- mRNAワクチンで用いられるスパイク蛋白質受容体結合ドメイン(S-RBD)が、受容体であるACE2を介して、ヒトiPS細胞から分化した心筋細胞に結合し、エンドリソソーム経路を介して取り込まれる過程を明らかにした。
- シングルセルRNA解析を用いて、S-RBDの取り込みにより、ヒトiPS細胞から分化した心筋細胞においてインターフェロン応答遺伝子の発現が上昇し、特にウイルス応答に関わる翻訳後修飾であるISG化が促進していることを示した。
- COVID-19ワクチン後の心筋炎について機序解明の一助となることが期待される。
概要
大阪大学大学院医学系研究科の大学院生 奥野翔太さん(循環器内科学)、肥後修一朗 特任准教授(常勤)(重症心不全内科治療学)、坂田泰史 教授(循環器内科学)らの研究グループは、COVID-19ワクチン接種後に心筋炎を発症するメカニズムを、ヒトiPS細胞由来分化心筋細胞を用いて検証しました。そしてmRNAワクチンで用いられるSARS-CoV-2ウイルスのスパイク蛋白質受容体結合ドメイン(S-RBD)が、iPS細胞由来分化心筋細胞にエンドリソソーム経路を介して取り込まれ、インターフェロン応答遺伝子を発現上昇させ、ウイルス応答に関わる翻訳後修飾であるISG化を促進させることを見出しました(下図)。COVID-19ワクチン後心筋炎の機序解明につながることが期待されます。
本研究成果は、英国科学誌「Scientific Reports」に、12月4日にオンライン公開されました。
図. SARS-CoV-2ウイルスのスパイク蛋白質受容体結合ドメイン(S-RBD)がISG化を促進する仕組み
研究の背景
SARS-CoV-2ウイルスによる新型コロナウイルス感染症(COVID-19)はパンデミックとして社会に深刻な脅威をもたらしました。ワクチンはパンデミックを抑えるための重要なツールです。ウイルス感染に重要なスパイク蛋白質の情報をコードし、スパイク抗原に対する免疫を誘導するmRNAワクチンは、COVID-19の感染、重症化、死亡を有意に低下させましたが、大規模接種開始後にmRNAワクチンと心筋炎の関連が明らかになりました。現在では、頻度は稀ですが、注意すべき副反応と考えられています。しかしながら、COVID-19ワクチン後心筋炎のメカニズムは未だ明らかではありません。
研究の内容
研究グループは、mRNAワクチンから産生されるSARS-CoV-2ウイルスのスパイク蛋白質受容体結合ドメイン(S-RBD)がiPS細胞から分化した心筋細胞に与える直接的な影響を検証しました。まず、ゲノム編集技術を用いてSARS-CoV-2ウイルス受容体であるACE2をノックアウトしたiPS細胞を作成することでS-RBDがACE2を介してヒトiPS細胞由来分化心筋細胞に取り込まれることがわかりました(図1)。また、S-RBDが取り込まれる過程を、S-RBDを蛍光蛋白質で標識してライブセルイメージングを用いて検出することに成功しました(図2)。
図1. ACE2野生型およびノックアウトiPS細胞由来分化心筋細胞におけるACE2とS-RBDの結合 ACE2野生型およびノックアウトiPS細胞を心筋細胞に分化させ、S-RBDを投与した後の免疫染色像です。野生型のiPS細胞由来分化心筋細胞ではACE2と結合するS-RBDが観察されますが、ノックアウトの心筋細胞ではACE2蛋白質の発現がなく、S-RBDの結合は観察されませんでした。
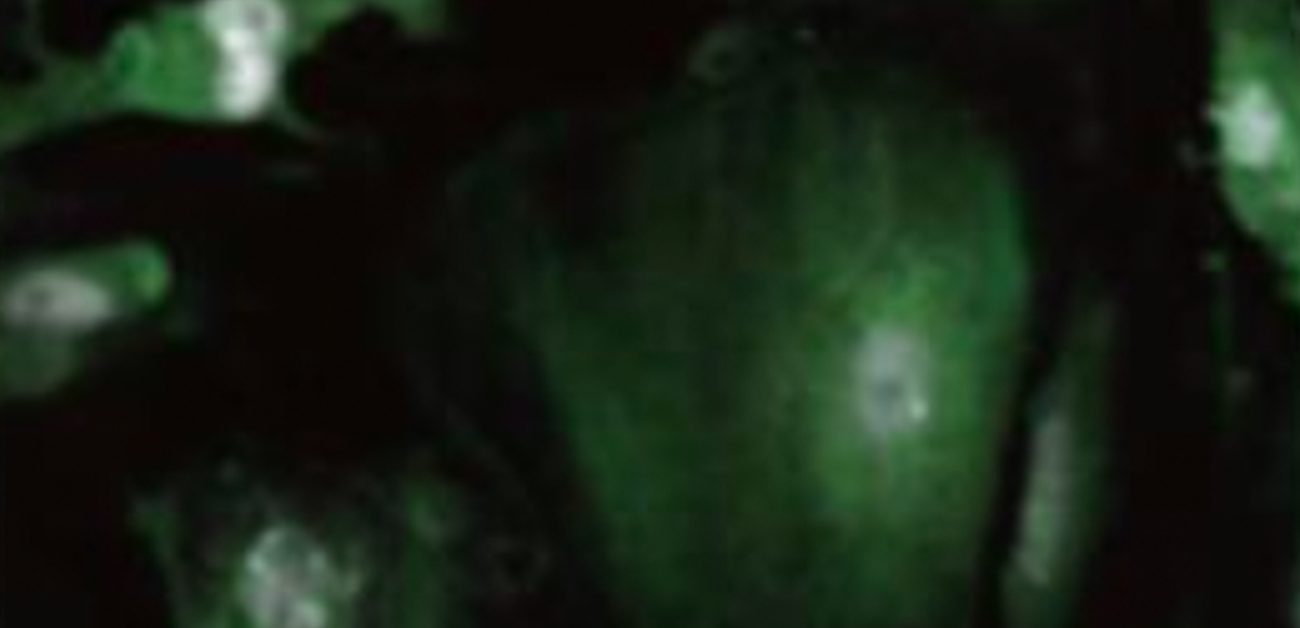
図2. iPS細胞由来分化心筋細胞における蛍光S-RBD蛋白質の取り込み過程のライブセルイメージング
iPS細胞由来分化心筋細胞において、S-RBD(緑色蛍光蛋白質で標識)と早期エンドソーム蛋白質であるRAB5A(赤色蛍光蛋白質で標識)の局在を共焦点顕微鏡で観察しました。
さらに、研究グループは、取り込まれたS-RBDが心筋細胞に与える影響を検証するために、S-RBD投与後の遺伝子発現変化を1細胞ごとに網羅的に定量するシングルセルRNAシークエンスを行いました。成熟心筋細胞において、インターフェロン応答遺伝子の発現が上昇しており、ISG15を介した翻訳後修飾であるISG化を促進することが明らかになりました(図3)。
図3. シングルセルRNA解析による成熟心筋細胞でのインターフェロン応答遺伝子の発現上昇とISG化の促進
シングルセルRNA解析により、全細胞集団は6つのクラスターに区別され(A、B)、成熟心筋細胞と定義されたクラスターにおいてインターフェロン応答遺伝子の発現が上昇し、ISG化が促進されていました(C)。
本研究成果が社会に与える影響(本研究成果の意義)
COVID-19に対するmRNAワクチン接種後に、特に若年者において心筋炎の発症リスクが増加することが明らかとなっています。本研究は、S-RBD蛋白質自体がヒト心筋細胞に炎症反応を引き起こすことを証明しました。COVID-19ワクチン後心筋炎の機序解明の一助となり、今後より副反応の少ないmRNAワクチン開発につながるとことが期待されます。
特記事項
本研究成果は、2023年12月4日(日本時間)に、英国科学誌「Scientific Reports」にオンライン公開されました。
タイトル:SARS-CoV-2 spike receptor-binding domain is internalized and promotes protein ISGylation in human induced pluripotent stem cell-derived cardiomyocytes
著者名:Shota Okuno1, Shuichiro Higo1,2,*, Takumi Kondo1, Mikio Shiba1, Satoshi Kameda1, Hiroyuki Inoue1, Tomoka Tabata1, Shou Ogawa1, Congcong Sun1, Saki Ishino3, Tomoyuki Honda4, Shigeru Miyagawa5, Yasushi Sakata1
- 大阪大学 大学院医学系研究科 循環器内科学
- 大阪大学 大学院医学系研究科 重症心不全内科治療学共同研究講座
- 大阪大学 大学院医学系研究科 附属最先端医療イノベーションセンター
- 岡山大学 大学院医歯薬学総合研究科 病原ウイルス学
- 大阪大学 大学院医学系研究科 心臓血管外科学
*. 責任著者
本研究は、日本学術振興会基盤研究B(21H02915)、挑戦的研究(萌芽)(22K19526)、若手研究(23K15128)、日本医療研究開発機構再生医療実現拠点ネットワークプログラム(21bm0804008h0005、22bm0804035h0001)、先進医薬研究振興財団、日本応用酵素協会、大阪大学クロスイノベーションイニシアティブ助成の支援を受けて行われました。
参考URL
大阪大学大学院医学系研究科 循環器内科学
http://www.cardiology.med.osaka-u.ac.jp/?page_id=33635
肥後 特任准教授(常勤)
https://researchmap.jp/s.higo
用語説明
- 新型コロナウイルス感染症(COVID-19)
SARS-CoV-2ウイルスによる感染症。2019年に中国武漢市で発見され、全世界に拡散した。肺炎を引き起こすだけでなく、重症化すると全身性炎症反応症候群をきたす。
- mRNAワクチン
標的蛋白質の設計図となるmRNAを利用したワクチンのこと。COVID-19のmRNAワクチンはスパイク蛋白質やスパイク蛋白質受容体結合ドメインを産生する。
- スパイク蛋白質受容体結合ドメイン(S-RBD)
SARS-CoV-2ウイルスのスパイク蛋白質の一部で、細胞に侵入する際のウイルス受容体であるACE2と直接結合する領域のこと。
- エンドリソソーム経路
細胞膜から取り込まれた物質が、初期エンドソーム、後期エンドソームを経由して、最終的にリソソームに到達する経路のこと。
- シングルセルRNA解析
ひとつひとつの単一細胞から網羅的な手法を用いて、転写産物の種類と量を検出する技術。
- インターフェロン
ウイルス感染に際して生体内でリンパ球などから産生され、分泌される生理活性物質。抗ウイルス作用、細胞増殖抑制作用、免疫調整作用などの生物活性を持つ。
- ISG化
ISG15による基質蛋白質の翻訳後修飾のこと。
- パンデミック
感染症が世界的に大流行し、非常に多くの患者を発生する状態。
- ノックアウト
遺伝子破壊と称され、細胞や生物に機能欠損型の遺伝子を導入する、遺伝子工学の技法。
- ライブセルイメージング
細胞を生きた状態で、個々あるいは集団の細胞の動きや形態の変化、また、遺伝子や蛋白質の発現などを可視化して外部から観察する手法。
- RAB5A
細胞膜からの小胞形成や初期エンドソームへの融合に関わる、初期のエンドサイトーシス経路において重要な役割をもつ蛋白質。
- ISG15
インターフェロン刺激により誘導され、細胞内で蛋白質の翻訳後修飾を起こし、蛋白質の機能や活性を変化させる役割をもつ蛋白質。
