トラウマ記憶はどのようにして脳内に作られるのか
光と機械学習で脳神経細胞ネットワークレベルの変化を初めて解明
研究成果のポイント
概要
恐怖心の制御は人や動物の生活で非常に重要です。強い恐怖体験の記憶、すなわち「トラウマ記憶」は、その時の状況と無関係に呼び起こされることがあります。フラッシュバックと呼ばれ、実生活に様々な不自由をもたらします。近年の研究によりトラウマ記憶に脳のどの部位が関わるかは分かってきましたが、そこでの詳細なメカニズムは未知の部分が多く、関連する精神疾患では決定的治療法が確立出来ていません。今回、自然科学研究機構・生理学研究所の揚妻正和准教授、鍋倉淳一所長、大阪大学産業科学研究所の永井健治教授らは、光学と機械学習の融合的新手法によりトラウマ記憶に関わる脳神経細胞ネットワークを検出することに成功し、記憶形成に伴う複雑な変化を捉え、トラウマ記憶が出来てくる仕組みを明らかにしました。本研究はNature Communications誌に掲載されました(日本時間2023年10月6日18時解禁)。
脳神経細胞ネットワークの変化を捉え、トラウマ記憶が生じる際の変化を初めて明らかに
研究の背景
恐怖心の制御は人や動物の生活で非常に重要です。一方、いわゆる「トラウマ(心的外傷)記憶」のように、強い恐怖体験の記憶が日常の無関係な感覚刺激によっても呼び起こされてしまうことも、しばしば起こります。侵入的想起、フラッシュバックと呼ばれ、脈絡無く引き起こされる辛さ・苦しさにより実生活に様々な不自由を強いられることが大きな問題です。
20世紀初頭からトラウマ記憶に関する研究は活発に行われてきました。たとえば、マウスが音を聞いている最中に、微弱な電気刺激を与えると、恐怖反応(すくみ)を示します。学習翌日には電気刺激を与えなくても音を聞かせるだけで恐怖反応を示し、音に対してのトラウマ記憶が形成されていることが分かります。これは、本来無害な「音」と元々嫌な「弱い電気刺激」を同時に経験すると、音に恐怖心を抱くようになる「恐怖連合学習」とよばれる仕組みであり、この実験系を使ったモデル動物の脳科学研究は、心的外傷後ストレス障害(PTSD)などトラウマに関わる精神疾患のメカニズム解明に有効と考えられています。
このようなトラウマが形成される際、脳の中ではどのような変化が起こっているのでしょうか?脳は、こうした感情や情動、そして関連する記憶を制御する重要な器官です。トラウマ記憶を制御する脳領域として、大脳皮質の「前頭前野」と呼ばれる部位の関与が多くの研究により指摘されています。さらに近年の研究により、トラウマ記憶は多くの神経細胞の集団(神経細胞集団)によって保持されていることまで分かってきました。
一般に脳神経細胞は、集団でネットワークを作ることでコンピューターのように情報処理を行うと考えられています。しかし、トラウマ記憶を情報処理するような神経細胞ネットワークは本当にあるのでしょうか。またそれらの細胞集団はどのような仕組みで生み出されるのでしょうか。トラウマ記憶のネットワークや、生み出されるメカニズムの理解が進めば、PTSDなどの難治性の精神疾患の治療法開発に新たな突破口をもたらすことが期待されます。
研究の内容
― トラウマが生まれる仕組みを調べる新たな手法を開発 ―
そこで生理学研究所の揚妻正和准教授(現在、量子生命科学研究所と兼任)、鍋倉淳一所長、大阪大学 産業科学研究所の永井健治教授らの研究グループは、東京大学、玉川大学、メキシコ自治大学、名古屋大学、大阪大学との国際共同研究により、脳の前頭前野に記憶されるトラウマの実態解明に着手しました。マウスを用いて、音・弱い電気刺激による恐怖連合記憶の実験系により研究を進めました。
トラウマ記憶が生まれるメカニズムを調べるには、その成立前後で、同じ細胞集団の活動を比較することが重要だと研究グループは考えました。そこで、「光」で、生きた動物の脳を長期的に計測できる「in vivo 2光子イメージング」に、「低侵襲なプリズム埋込法」「イメージング中に記憶課題を実施するための新装置」を統合した新しい手法を開発しました(図1、2)。それにより、トラウマ体験前と後の両方で、脳深部にある前頭前野の大規模な神経活動観察を実現し、神経細胞集団の活動「変化」からトラウマ記憶の実体を捉えることが可能となりました。
従来研究と異なり、トラウマ記憶の神経細胞集団を同定した上で、記憶獲得前の神経活動データに遡って違いを検出し、それにより「記憶が生まれる仕組み」の解明を目指しました。研究グループは、大規模神経活動データの解読から、トラウマ記憶(学習後に起こる恐怖反応)に強く関わる神経細胞集団の同定を試みました。しかし、従来手法では困難でした。観察対象である前頭前野が、恐怖記憶以外にも非常に多くの情報や脳機能を同時に制御していることが一因と考えました。そこでエラスティックネットと呼ばれる機械学習解析に着目し、その検出力の高さを生かした「トラウマ記憶を担う神経細胞集団を高精度で選別する手法」の開発に成功しました(図3左)。加えて、グラフィカルモデリングという更なる最新の数理解析技術により、トラウマ記憶を担う集団の中で神経細胞同士がどのように制御し合うか、すなわち「神経細胞ネットワーク内部の機能的結合状態」を算出し(図3右、図4)、トラウマ記憶の実体を詳細に調べました。
―トラウマが生まれる時、新たなネットワークが生まれていた ―
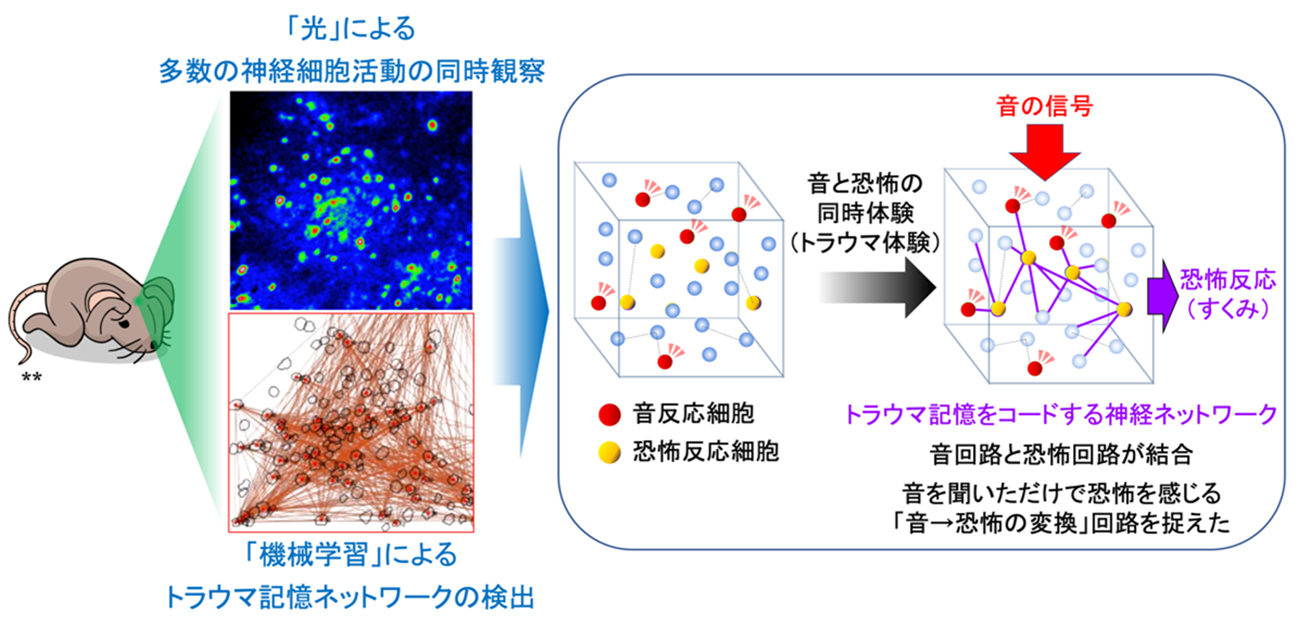
その結果、トラウマ体験後に新たに生まれる「トラウマ記憶の神経細胞ネットワーク」は、体験によって特定の細胞集団の内部結合(機能的結合)が増加することで出来ていることが分かりました(図4)。そしてグラフィカルモデリングの特性を生かしてネットワーク構造変化を詳細に調べたところ、トラウマ記憶の引き金となる「弱い電気刺激」に関連する神経細胞と、本来無害な「音」に関連する神経細胞は最初は無関係でしたが、トラウマ体験後に新たに機能的結合を作る(ネットワークを形成している)ことが分かりました。まさに「連合回路」が生まれていました。また、「弱い電気刺激」の神経細胞は、トラウマ記憶ネットワークの「ハブ」になるような役割持つ傾向があることが観察されました。これらの結果から、トラウマ記憶は、「トラウマ体験(弱い電気刺激)」に強く活動する細胞をハブとして、「経験依存的ハブネットワーク」を形成することが分かります(図5)。興味深いことに、PTSDの治療にも使われる「消去学習」により恐怖反応が出にくくなったマウスでは、これら神経細胞集団の活動およびその情報処理が破綻していることも観察され、このトラウマ記憶ネットワークの活動や情報処理を特異的に抑えることが治療への鍵になることも示唆されました。
今回、世界で初めて「体験がトラウマ化する際、恐怖体験に強く反応する神経細胞をハブとする新たな情報処理ネットワークを形成し、恐怖記憶に関する情報処理を行う様子」を捉えることに成功しました。
こうした細胞が恐怖記憶ネットワークの中心にいるということは、将来、その細胞の働きを抑えることができれば、PTSDなどトラウマ記憶による弊害を緩和することが出来るかもしれません。また、今回開発した神経ネットワーク評価法は、精神疾患治療薬の効果の新指標にもなるかもしれません。
図1. 顕微鏡下で恐怖連合学習と記憶想起を行うためのシステム開発
図2. 深部2光子イメージングによる前頭前野の活動記録と学習前後の比較
図3. 機械学習アルゴリズムを応用した神経活動データ解析法の開発
図4. 恐怖記憶神経ネットワークがトラウマ経験で生まれる様子を捉える
グラフィカルモデリングにより学習前後の変化を詳細に調べることが実現。
それぞれの丸が神経細胞を表し、赤色の線が機能的に結合しているペアを示す。
学習後には結合が増加している様子が分かる。更に図5のように他の特徴との比較も可能。
図5. 今回の発見のまとめ(詳細) ※ 図中**の画像はwww.canstockphoto.comより購入
本研究成果が社会に与える影響(本研究成果の意義)
記憶が生まれる仕組みは、長年科学者の議論の的となっていましたが、今回、トラウマ記憶の元となる恐怖体験中に強く活動する細胞が、結果として恐怖記憶の神経細胞ネットワークのハブのようになる「経験依存的なハブネットワーク形成」が観察されました。こうした細胞が恐怖記憶ネットワークの中心にいると言うことは、将来、その細胞の働きを抑えることができれば、PTSDなどトラウマ記憶による弊害を緩和することが出来るかもしれません。また開発したネットワーク評価法は、精神疾患治療薬効果の新指標になり得る可能性があります。
特記事項
【論文情報】
タイトル:Activity-dependent organization of prefrontal hub-networks for associative learning and signal transformation.
著者:Masakazu Agetsuma*, Issei Sato, Yasuhiro R Tanaka, Luis Carrillo-Reid, Atsushi Kasai, Atsushi Noritake, Yoshiyuki Arai, Miki Yoshitomo, Takashi Inagaki, Hiroshi Yukawa, Hitoshi Hashimoto, Junichi Nabekura, and Takeharu Nagai. (*責任著者)
雑誌:Nature Communications.
DOI: 10.1038/s41467-023-41547-5
本研究は科学技術振興機構・さきがけ、日本学術振興会・科学研究費助成事業、日本学術振興会・二国間交流事業、文部科学省科学研究費補助金、日本医療研究開発機構(AMED)脳とこころの研究推進プログラム(革新的技術による脳機能ネットワークの全容解明プロジェクト)、日本科学技術振興機構・ムーンショット型研究開発事業、自然科学研究機構・分野融合型共同研究事業、ブレインサイエンス財団研究助成、島津財団研究開発助成の補助を受けて行われました。
