世界最短波長蛍光タンパク質「Sumire」の開発に成功
生体内環境変化の因果関係を解明するための新技術
研究成果のポイント
- 世界最短波長の蛍光タンパク質Sumireを開発
- 細胞内における複数因子の同時測定が容易に
概要
大阪大学産業科学研究所の永井健治教授と杉浦一徳特任研究員(常勤)はこれまで発表された中で最も短い波長の蛍光を発するβバレル型蛍光タンパク質「Sumire」の開発に成功しました。 これにより細胞内で同時に観察できるパラメーターを増やすことができ、細胞内で起きる様々な生理現象の因果関係の解明に役立つと期待されます。
本研究成果は、英国科学誌 「Communications Biology」に、11月3日に発表されました。
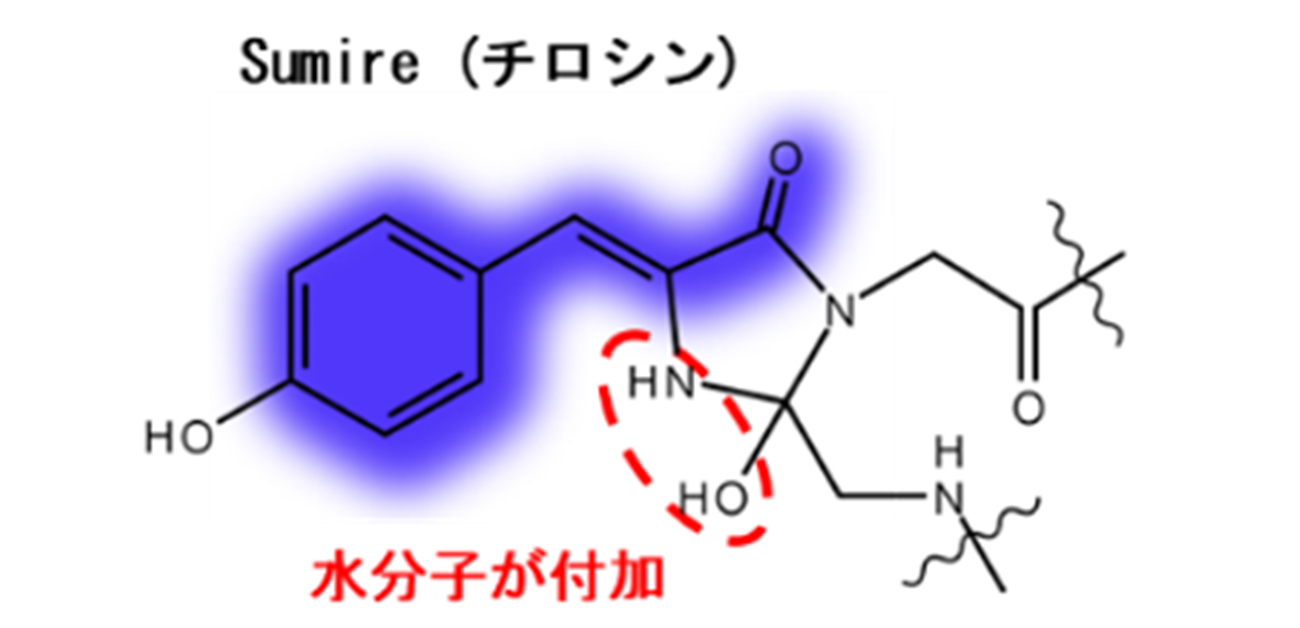
図1. 短波長側avGFP改変体の発色団構造
研究の背景
オワンクラゲ由来の緑色蛍光タンパク質(Aequorea victoria green fluorescent GFP: avGFP)は遺伝子を観察対象となる生物種に導入するだけで自発的に発色団を形成し蛍光を発します。その特性を用いて生体内の特定の分子を追跡するマーカーや、細胞内環境を非破壊的に測定するための機能性プローブの材料として、細胞生物学分野で広く利用されています。細胞内では多くのタンパク質や生体内小分子などが相互作用することで様々な生命現象を成立させています。生命現象を正しく理解するには細胞内における複数因子の変動を同時に観察し、その因果関係を解析することが重要になります。avGFPの多色化は細胞内における複数因子の同時観察に必須であり、これまでにも蛍光波長の異なる多くの改変体が作成されています。近年は特に赤色~近赤外の蛍光を持つ蛍光タンパク質の開発が精力的に進められていますが、その一方で、蛍光波長の短い青色側の蛍光タンパク質は2009年に永井研究室で開発された群青色蛍光タンパク質Siriusを最後に10年以上更新されていませんでした。
研究の内容
これまでに開発された短波長側のavGFP改変体の多くは、発色団を構成するチロシンを他の芳香族アミノ酸に置き換えることで発色団中のπ共役系を狭小化し、蛍光色を短波長にシフトさせていました。しかし、天然のタンパク質中に存在するチロシン以外の芳香族アミノ酸、トリプトファン、ヒスチジン、フェニルアラニンは既に、Cyan fluorescent protein (CFP)、Blue fluorescent protein (BFP)およびSiriusにそれぞれ利用されており、芳香族アミノ酸の置き換えによる、これ以上の多色化は困難でした。
そこで永井教授らは、蛍光タンパク質の発色団に対する水分子の付加を利用した蛍光波長の改変を試みました。発色団を構成する五員環部分に水分子が付加すると、五員環の一部がπ共役系から外れることで吸収波長が短くなります(図1)。このような水分子が付加した発色団については、一部のYellow fluorescent protein (YFP)改変体で報告がありましたが、そのままでは蛍光量子収率が小さく高い強度で蛍光を発することができませんでした。
本研究では、avGFPの改変体であるSuper folder GFP (sfGFP)に対して9カ所の遺伝子変異を加えることにより、水分子が付加した発色団の蛍光量子収率を改善しました。加えて、発光色を短波長化するための改変も行いました。GFP発色団を構成するチロシンのフェノール性水酸基は、蛍光タンパク質中で電離型、非電離型の二つの状態を取り、本来は非電離型の発色団の方が短い吸収・蛍光波長を持ちます。しかしavGFPやその改変体では、非電離型の発色団が励起状態プロトン移動(Exited state proton transfer: ESPT)によって瞬間的に電離し、蛍光波長が長波長側にシフトします。そこで、発色団を非電離型に保つとともに、ESPTの発生を抑え蛍光波長の長波長化を防ぐアミノ酸変異を導入しました。これらの工夫によりSiriusよりも短い波長の蛍光を発し、かつ3倍以上明るい蛍光タンパク質を開発するに至りました(図2)。この蛍光タンパク質はそのスミレ色の蛍光色にちなみ「Sumire」と名付けられました。
また、SumireとavGFP改変体のT-Sapphireを組み合わせることでFörster resonance energy transfer(FRET)型のカルシウムプローブvgCamを作成しました。vgCamの吸収波長は既存の蛍光タンパク質と大きく異なるため、他の機能性プローブと同時に細胞内に発現させても容易にシグナルを分離することができます。本研究では、動物培養細胞内にvgCamと、CFP・YFPを利用した既存のATPプローブ(Ateam1.03)を同時に導入し、生きた細胞内におけるカルシウムイオンとATPの濃度変化を同時に観察可能であることを示しました(図3)。
図2. sfGFP、SiriusおよびSumireの蛍光(実線)励起(破線)スペクトル
図3. FRET型プローブの模式図(左)と同一細胞内におけるカルシウム・ATP濃度変化の観察結果(右)
0分でヒスタミンを添加
本研究成果が社会に与える影響(本研究成果の意義)
本研究成果により、βバレル型蛍光タンパク質の短波長蛍光記録が13年ぶりに更新されました。本研究で示したSumireとT-Sapphireを利用してFRET型プローブを作成する手法は、カルシウムイオン以外の検出にも応用することができます。このようなSumireを用いたFRET型プローブを既存のプローブと同時に利用することで、様々な生命現象に伴う細胞内環境変化の因果関係を解明することが可能になります。
特記事項
本研究成果は、2022年11月3日英国科学誌「Communications Biology」(オンライン)に掲載されました。
タイトル:“Extension of the short wavelength side of fluorescent proteins using hydrated chromophores, and its application”
著者名:Kazunori Sugiura and Takeharu Nagai
doi: 10.1038/s42003-022-04153-7.
なお、本研究は、JST戦略的創造研究推進事業CREST「次世代フォトニクス」領域の研究課題「超解像「生理機能」イメージング法の開発と細胞状態解析への応用」(研究代表者:永井健治)および文部科学省、新学術領域研究「シンギュラリティ生物学」(研究代表者:永井健治)の一環として行われました。
参考URL
永井研究室ホームページ
https://www.sanken.osaka-u.ac.jp/labs/bse/
用語説明
- βバレル型蛍光タンパク質
βバレルと呼ばれる樽型の立体構造を持ち、特定の波長の光を吸収した際により長波長の蛍光を発するタンパク質の総称。sfGFPは490nm に吸収極大を持ち510 nmの蛍光を発するのに対し、改変後のSumireは343 nmに吸収極大を持ち414 nmの蛍光を発する。
- 発色団
π共役系を持ち、蛍光タンパク質中で実際に蛍光を発する分子団。avGFPやその改変体ではタンパク質を構成する238個のアミノ酸の内65番目から67番目までの3つのアミノ酸側鎖が自発的に環状化し発色団を作る。
- π共役系
交互に繰り返される単結合と二重結合からなり、非局在化された電子を持つ化学構造。一般的にπ共役系が長くなるほど長波長の光を吸収するようになる。
- 蛍光量子収率
蛍光分子が光を吸収した際に蛍光を発する割合。蛍光に変換されなかった分の光エネルギーは熱として発散される。
- 励起状態プロトン移動(Exited state proton transfer: ESPT)
非電離型のGFP発色団が励起された際に発色団の酸解離定数が低下し、チロシンのフェノール性水酸基のプロトンが近傍の水分子や酸性アミノ酸に移る現象。avGFPの非電離型発色団の場合ESPTが起きなければ450 nm付近の青色蛍光を発するが、ESPTが起こると電離型発色団同様に510 nmの緑色蛍光を発する。
- Förster resonance energy transfer (FRET)
蛍光分子が励起された際に、数nm以下のごく近傍に存在する他の色素分子に励起エネルギーが移動する現象。FRETが起こる効率は距離の6乗に反比例する。FRET型プローブは分子中に2種類の異なる蛍光タンパク質を持ち、測定対象となる分子の濃度に応じて構造が変化することでFRETの効率が変化し蛍光色が変化する。
- ATP
アデノシン3リン酸。生体内の様々な酵素反応でエネルギー源として使われることから「生体内のエネルギー通貨」とよばれる。
