がん細胞の増殖スピードを制御するメカニズムを解明
RNAメチル化酵素を標的にした新たながん治療法確立に期待
研究成果のポイント
- RNAメチル化酵素の構成因子METTL14には、様々ながんで体細胞変異が同定されている。
- METTL14のがん関連変異が、RNAのメチル化標的を変えることを発見。
- RNAのメチル化標的の変容が、がん細胞の増殖スピードを制御することを発見。
- RNAメチル化を標的とした、新たながんの治療法の確立に役立つことが期待される。
概要
大阪大学大学院医学系研究科の三宅浩太郎助教(呼吸器・免疫内科学)、河原行郎教授(神経遺伝子学)、熊ノ郷淳教授(呼吸器・免疫内科学)らの研究グループは、様々ながんで同定されているRNAメチル化酵素の構成因子であるMETTL14の遺伝子変異が、メチル化標的や効率を変容させることによって、がん細胞の増殖スピードを制御していることを、世界ではじめて明らかにしました。
RNA中のアデノシンのメチル化 (m6A修飾)は、全遺伝子の1/3に及ぶ非常に広範な遺伝子の発現を制御しており、METTL3/METTL14複合体が触媒しています。METTL14遺伝子には、子宮頸がん、膵がん、食道がん、胃がんなど様々ながんで体細胞変異が同定されており、特に298番目のアルギニン (R298)がホットスポットとして知られています。しかし、この変異がどのようにがんの進展と関連しているのかは不明でした。
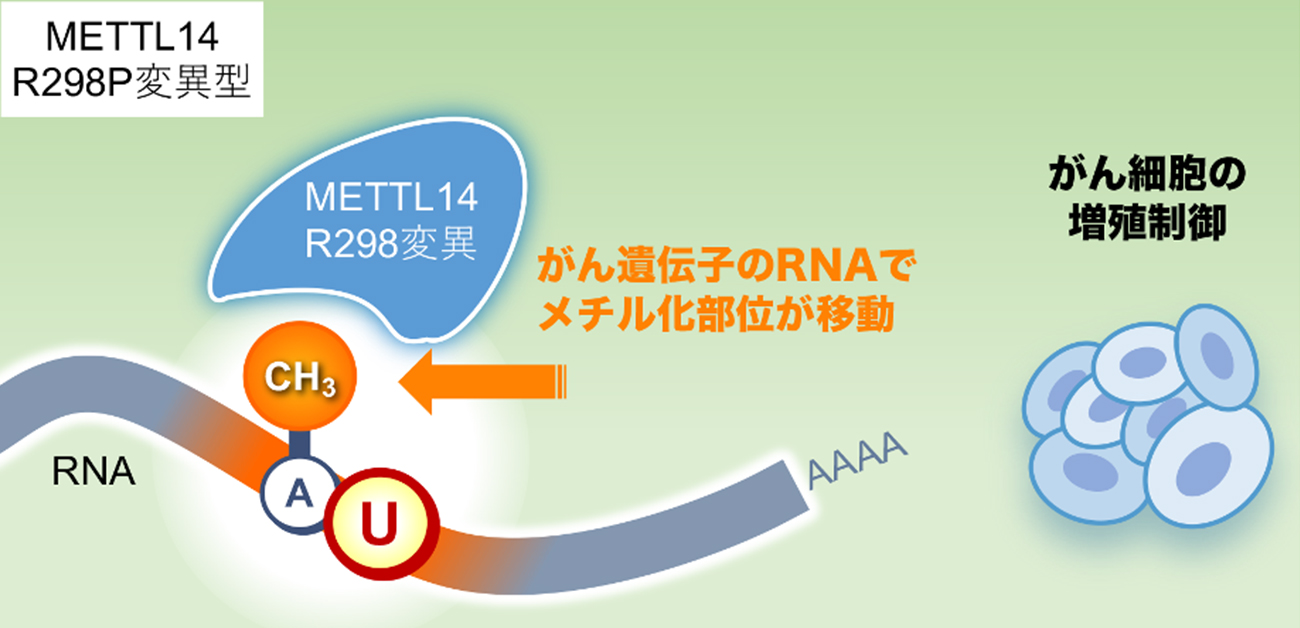
今回、研究グループでは、ゲノム編集技術を使ってがん細胞のMETTL14遺伝子にがん関連変異であるR298P変異 (アルギニンをプロリンに置換)を挿入しました。その結果、ヘテロ接合体ではがん細胞の増殖スピードが加速し、一方、ホモ接合体ではスピードが大きく減速することを見いだしました。また、R298P変異が、メチル化の効率を低下させるだけでなく、標的を変えてしまうことを発見し、この標的と効率の変容ががん細胞の増殖スピードを制御していることを明らかにしました。
今後、RNAメチル化の標的や効率を人為的に調整することによって、がん細胞の進展を制御する新たな治療法の開発が期待されます。
本研究成果は、米国科学誌Cell Reportsの電子版に、6月23日に公開されました。
研究の背景
DNA→RNA→タンパク質という順番に遺伝情報が流れ、最終的にタンパク質が細胞の内外で機能を発揮するというのは分子生物学の基礎です。RNAやタンパク質の量の多寡は精密にコントロールされており、適切なタイミングで適切な量のタンパク質が発現することが細胞の増殖・分裂・移動・分泌・老化・細胞死などあらゆる生命現象の基盤となります。これまでDNAやタンパク質の段階でどのように遺伝情報の発現がコントロールされているのかという点については広く研究が行われてきたものの、RNAを対象とした研究は世界的に見てもまだ始まったばかりという状況であり、今後多くの成果が期待される研究分野の一つです。
RNAはアデノシン (A)、グアノシン (G)、シチジン (C)、ウリジン (U)という4種類の塩基が直鎖状に並んだ構造をしており、その配列によって遺伝情報を伝えることを基本的な機能としています。そして近年、RNAに含まれるアデノシンに”メチル化”という小さな目印がつく現象 (m6Aメチル化修飾)が注目されています。「メチル化されたアデノシン」と「アデノシン」は遺伝情報としては全く同じ意味なのですが、メチル化されたRNAは分解されやすく、「メチル化されたアデノシン」の部位や量によってタンパク質の量が調整されることが明らかになっていました。このRNAのメチル化を担う酵素がMETTL3/METTL14複合体です。興味深いことに、このRNAのメチル化はランダムに起きるわけではなく、決まった配列(たとえばGGACU、モチーフと言います)の中のアデノシンに限ってメチル化されていることが知られていました。しかしどのようなメカニズムでこの決まった配列の中のアデノシンだけがメチル化されるのか、決まった配列にはどのような意味があるのか明らかになっていませんでした。
一方で、METTL14遺伝子には、子宮がん、膵がん、食道がん、胃がんなど様々ながんで、がん細胞特異的な体細胞変異が同定されてきました。特に、METTL14の298番目のアルギニンには変異が集中していますが(ホットスポット変異)、その意義の詳細は知られていませんでした。
研究の内容
今回、研究グループでは、ゲノム編集技術を用いて、がん関連変異の1つであるMETTL14 R298P変異を、子宮内膜がん由来のHEC108細胞株に挿入しました。興味深いことに、野生型と変異型を発現するヘテロ接合体では、がん細胞の増殖スピードが加速したのに対し、変異型のみ発現するホモ接合体では、増殖スピードが大きく減速しました。この変異型の細胞株のRNAについて質量分析法を用いて調べたところ、メチル化の効率が低下していることが判明しました。しかし、それだけでは、ヘテロ接合体とホモ接合体の増殖スピードの違いは説明できません。そこで、更に次世代シーケンサーを用いて詳細に調べたところ、変異を持ったMETTL14がGGAUUのような異常なモチーフを標的として認識しメチル化していることが明らかとなりました。このGGAUUの中のアデノシンのメチル化は、RNAの分解を担うRNA結合タンパク質が結合できませんでした。これらの解析から、ヘテロ接合体では、メチル化の効率低下によってRNAの分解速度が低下し、がん促進因子であるc-Mycの発現が上昇することで、がん細胞の増殖スピードが上昇することが分かりました。一方、ホモ接合体では、本来標的とはならない部位に異常メチル化が生じ、その結果c-Mycの発現が低下することで、がん細胞の増殖スピードが低下することが分かりました。これらの結果から、METTL14のがん関連変異が、メチル化の効率だけでなく、標的認識にも影響することで、がん細胞の増殖スピードを制御していることを明らかにしました。
本研究成果が社会に与える影響(本研究成果の意義)
本研究を通して、がんの増殖スピードがRNAのメチル化の標的や効率を操作することによって制御できることが明らかになりました。今後、METTL14の298番目のアルギニンに変異を持つがんだけでなく、幅広いがんにおいてRNAメチル化を操作することで、新たな治療法の開発につながることが期待されます。
特記事項
本研究成果は、2023年6月23日に米国科学誌Cell Reports(オンライン)に掲載されました。
タイトル:A cancer-associated METTL14 mutation induces aberrant m6A modification, affecting tumor growth
著者名:Kotaro Miyake1,*, Pedro Henrique Costa Cruz2, Izumi Nagatomo1, Yuki Kato2, Daisuke Motooka3, Shingo Satoh1, Yuichi Adachi1, Yoshito Takeda1, Yukio Kawahara2,*, Atsushi Kumanogoh1,4,*(*責任著者)
所属:
1. 大阪大学 大学院医学系研究科 呼吸器・免疫内科学講座
2. 大阪大学 大学院医学系研究科 神経遺伝子学講座
3. 大阪大学 微生物病研究所
4. 大阪大学免疫学フロンティア研究センター(IFReC)
DOI:https://doi.org/10.1016/j.celrep.2023.112688.
本研究は、革新的イノベーション創出プログラム(COISTREAM)、MEXT(Ministry of Education, Culture, Sports, Science and Technology)、日本医療研究開発機構(AMED)、科学研究費助成事業の一環として行われました。また創薬等先端技術支援基盤プラットフォーム(BINDS)の支援を受けています。
参考図
用語説明
- METTL14の遺伝子変異
METTL14の298番目のアルギニンに相当する部位に多数のがんで変異が同定されている (ホットスポット変異)。システインへ置換されたR298C (膀胱がん、膵がん)、ヒスチジンへ置換されたR298H (膀胱がん、膵がん、食道がん、胃がん)、プロリンへ置換されたR298P (子宮がん)などが知られている。
- m6A修飾
アデノシン (A)(参考図)の6位の位置にメチル基が挿入された修飾塩基をm6Aと呼ぶ。触媒酵素はいくつか知られているが、RNAの中でのタンパク質をコードしたmRNA (伝令RNA)のメチル化を触媒しているのが、METTL3 (methyltransferase-like 3)とMETTL14の複合体である。これらの酵素複合体は、GGACUのような決まった配列を認識してメチル化するが、多くは、mRNAの終止コドン近傍に生じる。メチル化されたmRNAは、これを読み取るタンパク質によって感知され分解されやすくなる。
- ホットスポット
遺伝子変異などが集中した特定の箇所のこと。主にがん遺伝子において高頻度に認められ、機能獲得を示唆する。
- ゲノム編集技術
2020年にノーベル賞を受賞した技術で、細胞の設計図であるゲノムの配列を書き換える(=編集する)ことを指す。CRISPR-Cas9という技術を用いることにより、特定の遺伝子の機能を失わせること、遺伝子の配列を書き換えることができる。本研究においてはこの技術を用いてがん細胞のゲノムを書き換え、興味がある遺伝子変異(今回はMETTL14の298番目の変異)を再現した。
