RNAの巻き方が自然免疫の活性化を制御することを発見!!
自己免疫疾患の治療法やRNAウイルス感染対処法の開発に期待
研究成果のポイント
- 通常の右巻き構造とは反対の左巻きZ型RNA(Z-RNA)に生じるRNA編集(RNA editing)が、自己RNAの識別に必須であることを発見した。
- Z型RNAを編集できないマウスが、ヒトの先天性免疫異常疾患であるエカルディ・グティエール症候群(AGS)によく似た症状を示すことを発見した。
- Z型RNAを標的とした新規AGS治療法の確立やコロナウイルスなどのRNAウイルス感染の早期感知や重症化予防法などへの応用が期待される。
概要
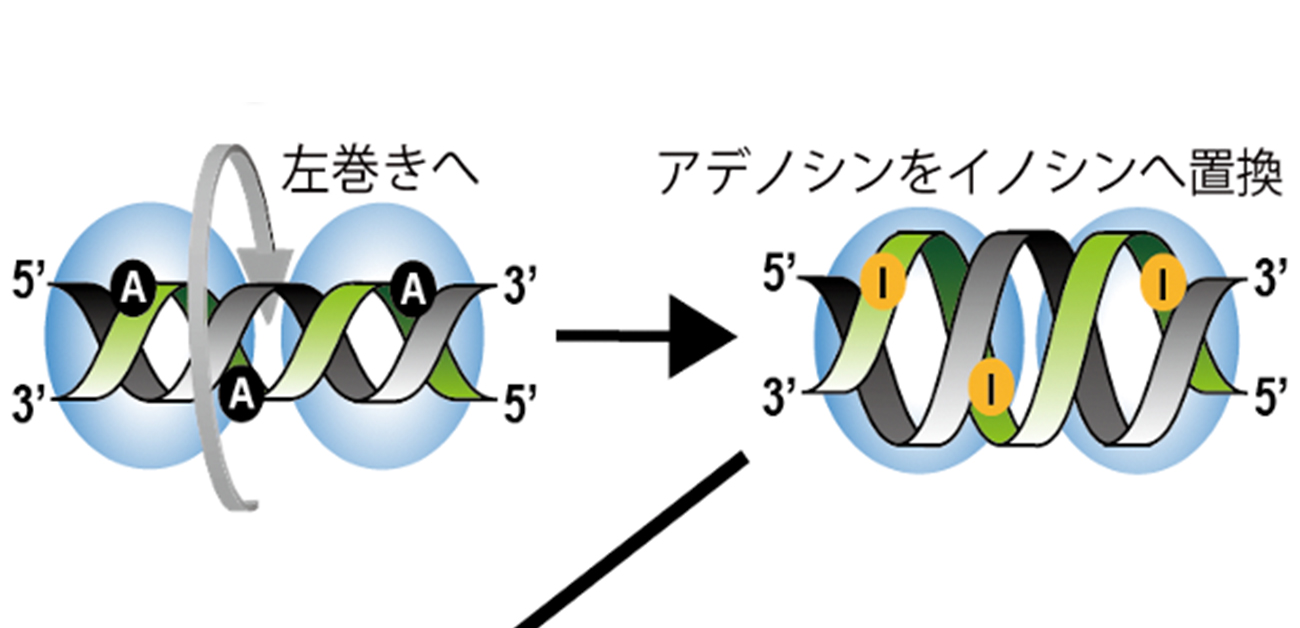
大阪大学大学院医学系研究科の中濱泰祐助教、河原行郎教授(神経遺伝子学)らの研究グループは、通常、右巻き(A型)であるRNAの一部が左巻き(Z型) になることが、適切なRNA編集を受け自己RNAに対する異常な免疫反応を防ぐことを世界で初めて明らかにしました(図1)。
DNAは2重らせん構造をとることがよく知られていますが、これは右巻きです。一方、私たちの体に発現しているメッセンジャーRNA (mRNA)は1本鎖ですが、分子内の相補性の高い配列間で部分的に2本鎖を形成することがあり、これも通常は右巻きです。ところが、試験管内の特殊な条件では左巻きになることがあり、また生体内にはRNAを左巻きにする活性を持ったタンパク質、Z型RNA結合タンパク質(Z-RNA binding protein)が発現していることが知られています。しかし、これまで、Z型RNAが生体内のどこで形成されるか分かっておらず、その生物学的意義も不明でした。
一方、RNAを左巻きにする活性を持ったタンパク質の1つに、2本鎖RNA中のアデノシンをイノシン(inosine)へと置換するRNA編集酵素ADAR1(adenosine deaminase acting on RNA type 1) があります。イノシンは修飾塩基の一種で、自己RNAの2本鎖にマークを入れていると考えられています。新型コロナウイルスなどのプラス鎖1本鎖RNAウイルスは、複製過程で多量の2本鎖RNAを作り出しますが、これをMDA5(melanoma differentiation-associated gene 5)と呼ばれる細胞内センターが感知し自然免疫を活性化させます。MDA5はイノシンでマークされた内在2本鎖RNAを感知しませんが、ADAR1によるRNA編集が適切に行われないと、MDA5が内在RNAを異物と誤認するリスクが生じます。実際、ADAR1の遺伝子変異はエカルディ・グティエール症候群(Aicardi-Goutières syndrome, AGS) という脳症を主症状とした先天性免疫異常疾患の原因となることが知られています。
今回、本研究グループは、ADAR1のZ型RNA結合ドメイン(ZBD)に遺伝子変異を導入し、Z型RNAに結合できないADAR1を発現したマウスを作製しました。このマウスを詳細に解析したところ、RNA編集が適切に実行されず、MDA5が内在RNAを異物と誤認することで異常活性化し、免疫反応が暴走していることが確かめられました。その結果、AGSとよく似た脳症を呈することも見出したことから、RNAを左に巻くことの生物学的重要性がはじめて明らかにされました。
今後、Z型RNAを標的とした新規AGS治療法の開発に繋がることが期待されます。また、新型コロナウイルスなどの複製過程で生じる2本鎖RNAにもZ型RNAは形成されていると想定されることから、ウイルス感染を早期に感知する手法や重症化予防法の開発につながることが期待されます。
本研究成果は、米国科学誌「Immunity」の電子版に、9月15日(水)午前0時(日本時間)に公開されました。
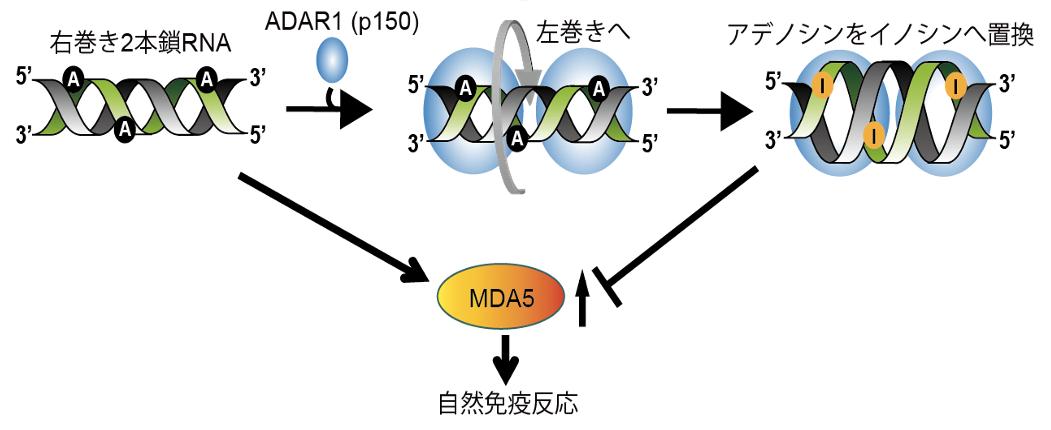
図1. ADAR1を介したRNA編集により2本鎖RNA中のアデノシン(A)がイノシン(I)へと置換されると、この2本鎖RNAはMDA5によって異物と誤認されなくなる。この一連の過程に、ADAR1が2本鎖RNAの一部を右から左巻きに変えることが不可欠であることを発見
研究の背景
新型コロナウイルスmRNAワクチンの合成に修飾塩基(メチル化シュードウリジン)が使われたことで、修飾塩基の重要性が注目されています。修飾塩基の入ったRNAは、細胞内の様々なRNAセンサー分子の感知を回避できます。MDA5もウイルスRNAセンサー分子として長い2本鎖RNAを感知しますが、自己RNAは通常認識しません。これは、自己RNAに形成される2本鎖RNA部分にRNA編集によってイノシンと呼ばれる修飾塩基が挿入されるためです。しかし、2本鎖RNA構造は完全なものから不完全なものまで多種多様に形成されるため、どのRNAにイノシンを挿入する必要があるのか、詳細は不明でした。
一方、MDA5による自己RNAへの感知を回避するには、ADAR1を介したRNA編集が必要不可欠であることがこれまで分かっていました。また私たちは最近、核に局在するADAR1 p110というアイソフォームにはこの効果がなく、細胞質に局在するADAR1 p150というアイソフォームが担当していることを明らかにしました。このADAR1 p150には、特徴的なZ型RNA結合ドメイン(ZBD)が存在していますが、これまでその役割は不明でした。しかし、このドメイン内に先天性免疫異常疾患であるエカルディ・グティエール症候群(AGS)の原因遺伝子変異が見つかっていることもあり、私たちはこのドメインの役割に着目しました。
Z型構造は最初DNAで確認されました。通常の2重らせん構造は右巻きですが、左巻きのZ型DNA構造は転写のプロセスで形成されると考えられており、転写効率やゲノム不安定性に影響するとされています。一方、mRNAは1本鎖ですが、相補性の高い領域内で2本鎖RNA構造を形成することがあります。通常はこの構造も右巻きですが、試験管内の特殊な条件下でDNAと同様に左巻き (Z型RNA)になることが分かっています。しかし、完全相補なDNAとは違い、RNAの2本鎖構造は多種多様なため、左巻きのZ型RNAについては生体内でどのように形成されるのか、またその意義も全く分かっていませんでした。
本研究の成果
研究グループは、ADAR1がZ型RNAに結合する際に必要不可欠なアミノ酸残基 (197番目のトリプトファン)をアラニンに置換し (W197A)、Z型RNAに結合できないADAR1を発現するマウスを作製しました。その結果、本マウスがAGSとよく似た脳症を呈することを見出しました(図2)。また、RNA編集が適切に実行されないことでMDA5が異常活性化し、各臓器で自然免疫反応が暴走していることを明らかにしました(図2右上)。これらの結果から、私たちは、ADAR1がZ型RNAを認識しRNA編集を実行することが、MDA5によって自己の2本鎖RNAを異物と誤認させないようにするために不可欠であることを解明しました(図1)。
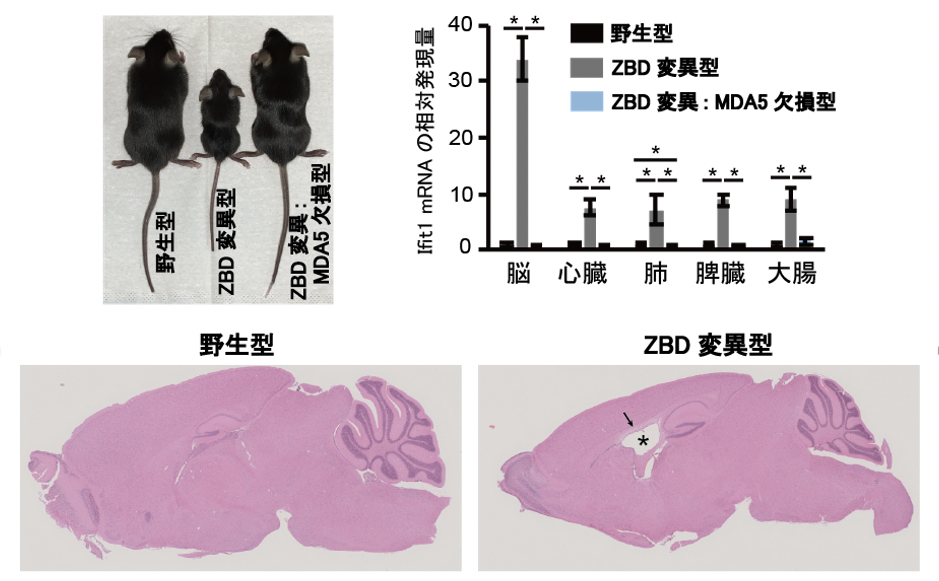
図2. Z-RNA結合ドメイン(ZBD)に変異を入れたマウスは、小型で痩せており、脳室の拡大(⋆)や白質の菲薄化(矢印)などAGS様脳症を呈した。また、MDA5が異常活性化し、各種臓器でインターフェロン関連遺伝子(Ifit1)の上昇が認められた。
本研究成果が社会に与える影響(本研究成果の意義)
希少疾患であるエカルディ・グティエール症候群(AGS)は、その病態形成機構が十分には分かっておらず、治療法も確立されていません。本研究成果が、Z型RNAを標的とした新規AGS治療法の確立に繋がるものと期待されます。
また、一部のウイルスはZBDを含むタンパク質を持っていることが知られており、これを感染に利用しています。RNAウイルスの中には、そのゲノムRNAにZ型RNAが形成されていることを示唆する報告もあります。このため、更に知見を積み重ねることで、こうしたウイルス感染を早期に感知する手法、毒性を軽減する手法、重症化を防ぐ方法など多方面に応用することが期待されます。更にワクチンに使われている人工mRNAは、長くなると予期せず2本鎖RNAを形成しMDA5に感知されるリスクも高まります。このため、安全なmRNAの合成技術の確立にも役立ちます。
特記事項
本研究成果は、2021年9月14日(火)午前11時(米国東部時間)〔9月15日(水)午前0時(日本時間)〕に米国科学誌「Immunity」(オンライン)に掲載されました。
【タイトル】“Mutations in the adenosine deaminase ADAR1 that prevent endogenous Z-RNA binding induce Aicardi-Goutières syndrome–like encephalopathy”
【著者名】Taisuke Nakahama1, Yuki Kato1,2, Toshiharu Shibuya1, Maal Inoue1, Jung In Kim1, Tuangtong Vongpipatana1, Hiroyuki Todo1, Yanfang Xing1 and Yukio Kawahara1,2,3
【所属】
1.大阪大学 大学院医学系研究科神経遺伝子学教室
2.大阪大学 先導的学際研究機構
3.大阪大学 大学院医学系研究科附属共同研ゲノム編集センター
DOI:https://doi.org/10.1016/j.immuni.2021.08.022
なお、本研究は、日本医療研究開発機構(AMED)難治性疾患実用化研究事業、日本学術振興会(JSPS)科学研究費補助金研究の一環として行われました。
用語説明
- 左巻きZ型RNA (Z-RNA)
1979年アレクサンダー・リッチらによって、CGの繰り返しDNA配列が左巻き二重らせん構造をとることが示された (Z型DNA)。更に1984年にRNAについても、試験管内で塩濃度を高めるなどすることによって左巻きに変換されることが示された。
- RNA編集 (RNA editing)
真核生物に保存された転写後修飾の一種であり、アデノシンをイノシンへと置換するRNA編集はADARファミリーに触媒される。ヒトやマウスではADAR1の他にADAR2が触媒活性を有し、いずれも2本鎖RNA結合ドメインを持つ。このため、転写後のmRNAの中で部分的に2本鎖を形成しやすい性質を持つレトロトランスポゾン由来配列がその標的となりやすく、ヒトでは部位にして100万箇所以上、転写産物の実に85%がこの修飾を受ける。
- Z型RNA結合タンパク質 (Z-RNA binding protein)
これまでに5種類が同定されており、このうち哺乳類ではADAR1とZBP1 (Z-DNA-binding protein 1)の2つが知られている。Z型のRNAだけでなく、Z型のDNAにも結合できる。E3L(ワクシニアウイルス)やORF112(ヘルペスウイルス)など一部のウイルスも保有していることから、左巻きRNA/DNAはウイルスにとっても不可欠な役割があると考えられる。なお、ワクシニアウイルスは天然痘ワクチン中の有効成分であるが、Z型RNA結合ドメインに変異を入れると無毒化できることが知られている。
- イノシン (inosine)
修飾塩基の一種。tRNAやmRNAに幅広く存在している。mRNA中のイノシンは、ADARによるRNA編集によって、アデノシンが脱アミノ化することで置換される。
- ADAR1 (adenosine deaminase acting on RNA type 1)
ADARファミリーの一種であり、2本鎖RNA中のアデノシンをイノシンへと置換するRNA編集酵素。同じ遺伝子座において異なるプロモーターより転写されてできる細胞質型ADAR1 p150と核型p110の2つのアイソフォームが存在する。このうち、Z-RNAに結合できるのは、ADAR1 p150だけである。
- MDA5 (melanoma differentiation-associated gene 5)
細胞内にはウイルスなどに由来する外来RNAを認識するセンサー分子が存在しており、MDA5は細胞質に局在して、比較的長い2本鎖RNA (>300塩基)を認識する。近年、新型コロナウイルス複製時に合成される2本鎖RNAがMDA5によって認識され、自然免疫応答が惹起されるとの報告が増えている。MDA5が自己RNAを異物と誤認しないように、生体内ではRNA編集によって自己RNA中の2本鎖RNAにイノシンを挿入している。なお、MDA5以外のRNAセンサー分子は、メチル化アデノシン、シュードウリジン、メチル化シュードウリジンなどの修飾塩基があると異物と認識しなくなる。新型コロナウイルスmRNAワクチンでは、この原理を応用してウリジンの代わりにメチル化シュードウリジンが使用されている。
- エカルディ・グティエール症候群(Aicardi-Goutières syndrome, AGS)
インターフェロン(IFN)の異常産生に起因する脳症を主症状とし、凍瘡様皮膚症状、ウイルス感染様肝炎、間質性肺炎など多彩な症状を呈する希少疾患。多くは生後まもなく発症し、10歳までに死に至る。現在までに7つの原因遺伝子が報告されており、その中にADAR1(6型AGS)とMDA5(7型AGS)が含まれている。それぞれの変異が、ADAR1の機能低下あるいはMDA5の異常活性化を引き起こすことでAGSを発症するものと考えられている。
