パーキンソン病の発症の源流を解明
ホスファチジルイノシトール3リン酸による蛋白質凝集
研究成果のポイント
- パーキンソン病(PD)患者の脳内ではαシヌクレイン(αSyn)という蛋白質が凝集して蓄積する事が広く知られているが、その原因は一部の患者を除き不明であった。我々はこれまでの患者脳の研究でαSyn凝集体にはなんらかの脂質が中心にあることを見出しており、脂質がαSynの性質を変えて凝集させるという仮説を立てた。
- ホスファチジルイノシトール3リン酸(PIP3)をαSynと強く結合する脂質として同定した。
- 神経細胞や線虫を用いた実験、また患者の脳の研究で、PIP3の蓄積がαSynの凝集、蓄積を引き起こしていることを明らかにした。
- PD発症の最上流ともいえる病態を解明するに至った。PDのバイオマーカーの可能性や過剰なPIP3を抑制する治療やPIP3とαSynの結合を阻害する治療など、この発見に根差した全く新しい治療法の開発につながると確信する。
概要
大阪大学大学院医学系研究科鐘其静特任研究員、池中建介助教、望月秀樹教授(神経内科学)らの研究グループは、PD患者にPIP3というリン脂質が蓄積することが、PDの原因と考えられてきたαシヌクレイン(αSyn)の異常な凝集体(レビー小体)の原因となることを明らかにしました。これまで、約1割程度のPD患者さんでは、グルコシルセラミドという糖脂質が脳で蓄積してαSynが凝集することが知られていましたが、それ以外のPD患者さんにおいてαSynが凝集蓄積する理由は解明されていませんでした。
今回、研究グループは、αSynに結合して凝集を促進する脂質をスクリーニングし、PIP3が強くαSynに結合し、パーキンソン病患者の脳内で溜まっているαSyn凝集体と形や性質が類似する凝集体を作ることを見つけました。さらに、神経細胞や線虫においてPIP3が蓄積する環境を再現すると、リソソームやシナプス終末といった、PD患者でαSynの凝集が高頻度にみられる細胞内器官にαSynが凝集することを示しました。亡くなられた患者さんの脳組織を見てみると、PIP3が、脳幹という病初期からαSynが蓄積する場所でPIP3の量が増えており、αSynと一緒に凝集していることを明らかにしました。これまで大部分が不明であった患者脳内でαSynが凝集を開始する原因の一つが明らかになり、新しい治療の可能性が見えてきました。
本研究成果は、2023年3月20日(日本時間)に欧州科学誌「Acta Neuropathologica」(オンライン)に掲載されました。
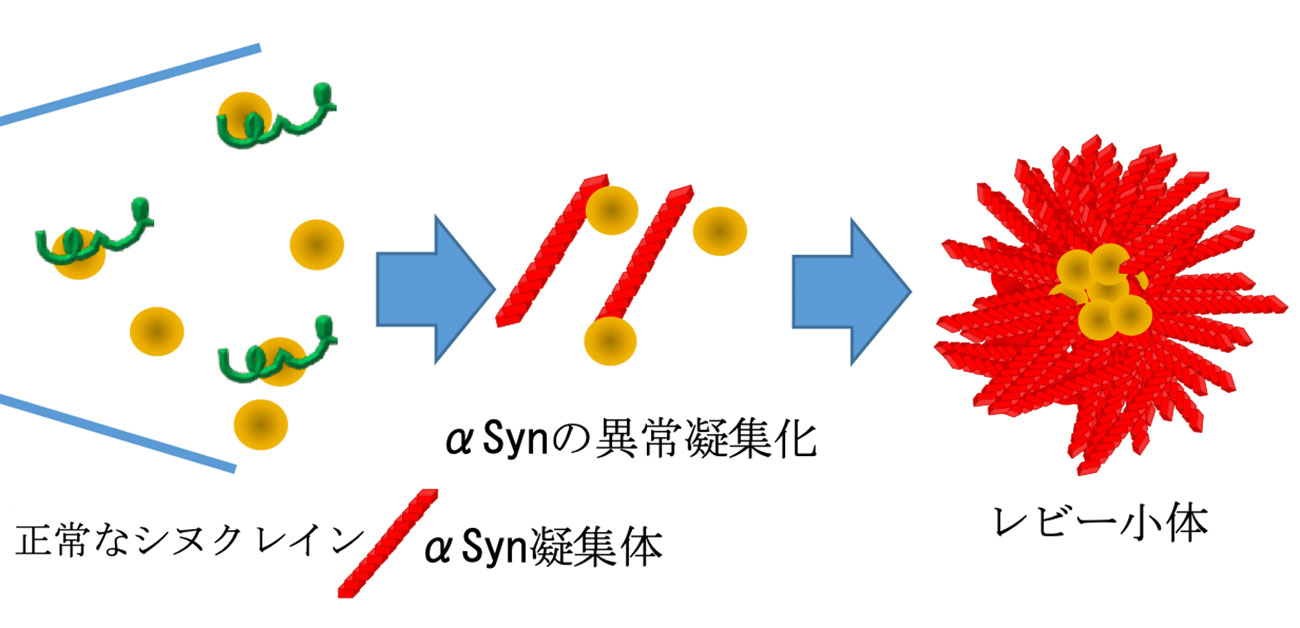
図1. 過剰なPIP3がαSynと結合してレビー小体を作る
研究の背景
これまで、パーキンソン病の原因にαシヌクレイン(αSyn)の凝集(レビー小体)が中心的な役割を果たしていることが広く知られていました。しかし、なぜαSynが凝集蓄積するのか十分に分かっていませんでした。およそ1割程度の患者さんでは、遺伝的に糖脂質のグルコシルセラミドが蓄積しやすい体質をもち、過剰なグルコシルセラミドがαSynと結合して凝集を起こすことが知られていましたが、それ以外の9割の患者さんの原因は不明でした。しかし、研究グループは、残りの患者さんたちのレビー小体にも、αSynの凝集と一緒に何らかの脂質が蓄積していることは、以前の研究で見出していました。そこで研究グループは、脂質がαSynの性質を変えて凝集させるという仮説を立てました。
研究の内容
池中助教らの研究グループでは、αSynと結合する脂質をメンブレンストリップ法で探索したところ、ホスファチジルイノシトール3リン酸(PIP3)が強く結合することを見出しました。さらにPIP3とαSynを混ぜたところ、αSynが異常な構造をもつ凝集体を作ることがわかりました。この凝集体の形や性質を調べたところ、いくつかあるαSynが蓄積する病気の中で、特にパーキンソン病患者さんの脳内で蓄積するαSyn凝集体と形や性質が類似していることを明らかにしました。次に、培養細胞や神経細胞においてPIP3が蓄積する処置をすると、リソソームやシナプス終末といった、実際の患者さんでαSynが凝集を開始する場所においてPIP3と一緒に凝集蓄積するαSynが観察されました。患者さんの脳組織のPIP3の量を、質量分析や免疫染色を用いて測定したところ、PD患者において過剰に蓄積していることがわかりました。さらに免疫染色でαSyn凝集体とPIP3が一緒に凝集していることを示しました。これらの結果から、PIP3の過剰な蓄積が、PD患者においてαSynのレビー小体形成のきっかけになっていることを示唆し、これまで明らかにされてこなかったαSyn凝集のきっかけの一部を解き明かしたことになります。
本研究成果が社会に与える影響(本研究成果の意義)
本研究成果によってαSyn凝集のきっかけが解き明かされたことで、PIP3がPDのバイオマーカーの可能性やPIP3の過剰な蓄積を抑える治療や、αSynとの結合を阻害する治療といった全く新しい治療戦略が今後展開されるものと考えます。
特記事項
本研究成果は、2023年3月20日(日本時間)に欧州科学誌「Acta Neuropathologica」(オンライン)に掲載されました。
タイトル:“Phosphatidylinositol-3,4,5-trisphosphate interacts with alpha-synuclein and initiates its aggregation and formation of Parkinson’s disease-related fibril polymorphism”
著者名:Chi-Jing Choong1, César Aguirre1, Keita Kakuda1, Goichi Beck1, Hiroki Nakanishi2, Yasuyoshi Kimura1, Shuichi Shimma3, Kei Nabekura1, Makoto Hideshima1, Junko Doi1, Keiichi Yamaguchi4, Kichitaro Nakajima4, Tomoya Wadayama1, Hideki Hayakawa1, Kousuke Baba1, Kotaro Ogawa1, Toshihide Takeuchi5, Shaymaa Mohamed Mohamed Badawy1, Shigeo Murayama6, Seiichi Nagano1, Yuji Goto4, Yohei Miyanoiri7, Yoshitaka Nagai5, Hideki Mochizuki,1*, and Kensuke Ikenaka1*(*責任著者)
所属:
1. 大阪大学 大学院医学系研究科 神経内科学
2. 株式会社リピドームラボ
3. 大阪大学 大学院工学系研究科 生物工学専攻
4. 大阪大学 大学院基礎工学研究科 機能創成専攻
5. 近畿大学 医学部 内科学教室 脳神経内科部門
6. 大阪大学 大学院連合小児発達学研究科附属子どものこころの分子統御機構研究センター、ブレインバンク・バイオリソース部門
7. 大阪大学 蛋白質研究所 蛋白質次世代構造解析センター高磁場NMR分光学研究室
DOI:https://doi.org/10.1007/s00401-023-02555-3
本研究は、JST戦略的創造研究推進事業「細胞外微粒子に起因する生命現象の解明とその制御に向けた基盤技術の創出研究」、AMED疾患基礎研究事業部「革新的技術による脳機能ネットワークの全容解明プロジェクト」、および大阪大学産学連携プロジェクトMEETの一環として行われました。
参考URL
用語説明
- パーキンソン病
主に中年以降に発症する神経変性疾患の1つで、手足のふるえや動作緩慢といった運動症状を呈します。
- αシヌクレイン(αSyn)
中枢神経に豊富に発現している蛋白質で、これが神経細胞内で凝集体を形成することがパーキンソン病の病態に深く関与することが知られています。
- ホスファチジルイノシトール3リン酸(PIP3)
細胞膜やリソソーム膜、シナプスといった細胞内部位に存在するリン脂質。細胞内外の信号を伝えるシグナル分子として働いている。
