病原体センサーは「タップ」と「長押し」を区別していた
限られた数のセンサーで無数の病原体を識別する仕組みを解明
研究成果のポイント
- センサーによる病原体認識の「時間」と「強さ」の違いが異なる細胞応答を誘導することを発見
- 無数の病原体に対して限られた数のセンサーが適切な応答を誘導する生体の仕組みを解明
- 生体センサーの仕組みを応用した新規技術開発にも期待
概要
大阪大学微生物病研究所の山崎晶教授(免疫学フロンティア研究センター、感染症総合教育研究拠点兼務)、渡邊美幸研究員(現・九州大学学術研究員)、元岡大祐助教の3人からなる研究グループは、病原体センサー(受容体)からの刺激の持続時間や強さが変わると応答が異なることを見出し、その仕組みを明らかにしました。限られた数の受容体で、多様な病原体を感知し適切な応答を誘導するための巧妙な仕組みと考えられます。本発見は、病原体に応じた特異的な免疫賦活法の開発や、精巧な生体センサーの仕組みを応用した情報伝達システムの開発につながることも期待されます。
本研究成果は米国科学誌「Science Signaling」に日本時間3月8日(水)午前4時に公開されました。
タイトル:“The kinetics of signaling through the common FcRγ chain determine cytokine profiles in dendritic cells”
著者名:Miyuki Watanabe, Daisuke Motooka and Sho Yamasaki
図1. 病原体センサーが多様な標的を見分ける仕組み
病原体からのシグナルの「時間」や「強さ」を見分けることで、異なる細胞応答を誘導し多様な病原体に対応している。
研究の背景
無数の病原体に対して、ゲノム上にコードされた受容体の数は限られています。ところが、どのようにして限られた種類の受容体で多種多様な(時には予測不能な)病原体を感知し、適切な応答を誘導しているのかは分かっていませんでした。この仕組みが分かれば、今後、病原体に特異的な免疫応答を人為的に誘導することが可能になるとも期待されます。
研究の内容
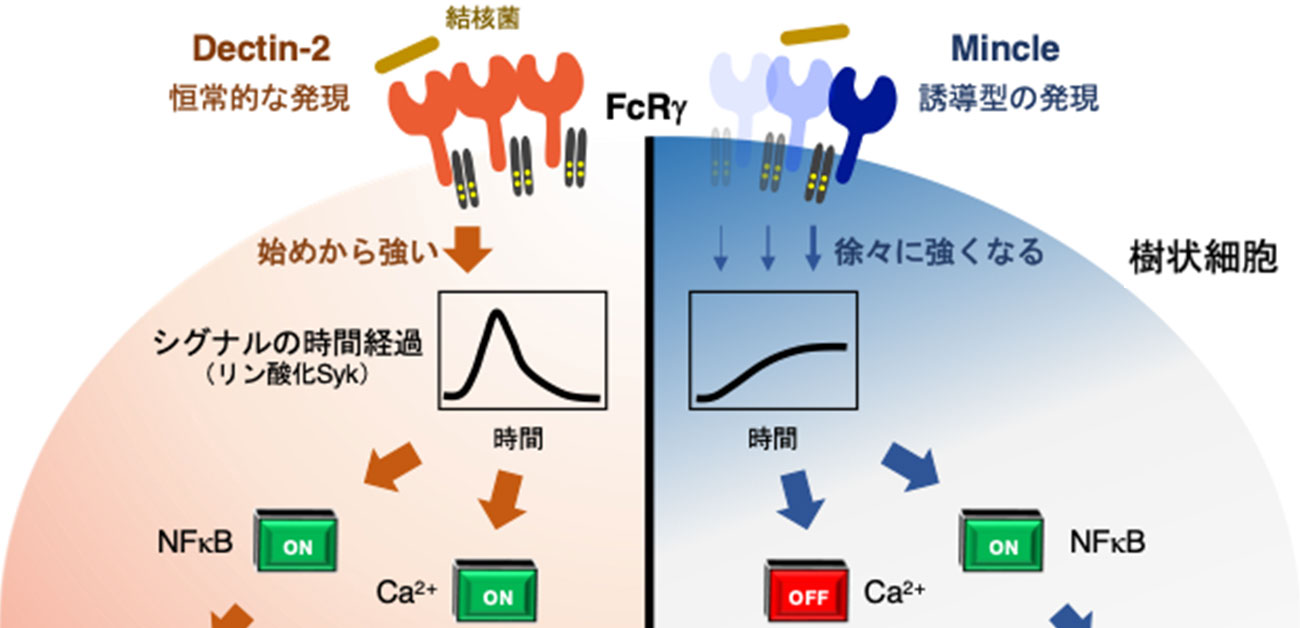
本研究グループでは、同じFcRγと会合する2種類の受容体(Dectin-2とMincle)についてサイトカイン産生を指標に応答を比較しました。その結果、同一のFcRγを介して活性化シグナルが入るにも関わらず、Dectin-2を刺激した時にしかIL-2産生を誘導できないことが分かりました(図2)。次に、FcRγの下流シグナルの質を比較したところ、Dectin-2は始めから強い刺激が入るのに対して、Mincleでは弱く持続した刺激であることを明らかにしました(図3)。
図2. Dectin-2とMincleのサイトカイン産生能の比較
Dectin-2シグナルでしかIL-2産生は誘導されない。一方で、TNF産生は両方の受容体からのシグナルで誘導される。
図3. Dectin-2とMincleの細胞内応答の経時的比較
FcRγ直下のシグナル分子Sykのリン酸化を経時的に比較すると、Dectin-2では刺激早期に強いリン酸化が検出される一方でMincleでは遅れる。同時に、クロマチン動態をATAC-Seq解析、遺伝子発現をRNA-Seq解析にて比較すると、Dectin-2の早いシグナルでしか誘導できない応答とシグナルが早くても遅くても誘導できる応答に区別できる。
この応答の違いは受容体の発現パターンを反映しており、発現様式を調節してMincleを恒常的に発現させると、IL-2産生を誘導できるようになることも分かりました(図4)。また、受容体は「強弱」を見分けていることも分かりました。さらに、その「時間」「強さ」を応答の違いに変換するスイッチの候補として、下流分子のリン酸化・セカンドメッセンジャー・クロマチン動態・遺伝子発現を経時的に比較したところ、Dectin-2シグナルの時だけカルシウム応答がONになり、転写因子NFATの活性化と特定のゲノム領域の開きを確認しました(図5)。実際にそのゲノム領域を欠失したマウスを作成するとサイトカイン産生が低下しました(図5)。以上から、同一のシグナルサブユニットから多様性を作り出す分子メカニズムの一端が明らかになりました。
図4. 発現調節によるシグナルの変換
Dectin-2は恒常的に発現しているがMincleは刺激に伴い発現してくる。そこで、MincleをDectin-2のように発現させたマウス(Mincle Tg)での応答を調べると、Dectin-2のような早いシグナルに変化しIL-2産生能を獲得する。
図5. Dectin-2シグナルが制御するIl2発現調節領域の同定
Il2遺伝子の上流には早いシグナルを誘導できる条件でのみ開く領域が存在する。その領域には転写因子NFATの結合モチーフが集積し、実際にNFAT上流のカルシウム応答もDectin-2シグナルだけで活性化している。このNFAT結合領域を含むオープンクロマチン領域を欠失するマウスではDectin-2シグナルでのIL-2産生が低下する。
本研究成果が社会に与える影響(本研究成果の意義)
本研究成果により、ゲノムにコードされた限られた種類の受容体で、多種多様な病原体を見分ける生体の仕組みの一端が明らかとなりました。今後、病原体の種類に応じた、副反応の少ない効果的な免疫賦活法の確立や、生体の精巧なシステムを応用した新たなセンサー技術開発への応用が期待されます。
特記事項
本研究成果は米国科学誌「Science Signaling」に日本時間3月8日(水)午前4時に公開されました。
タイトル:“The kinetics of signaling through the common FcRγ chain determine cytokine profiles in dendritic cells”
著者名:Miyuki Watanabe, Daisuke Motooka and Sho Yamasaki
DOI:https://doi.org/10.1126/scisignal.abn9909
なお、本研究は、AMED-CREST「画期的医薬品等の創出をめざす脂質の生理活性と機能の解明」及びJSPS学術変革領域研究(A)「生体防御における自己認識の功と罪(自己指向性免疫学)」の一環として行われました。
参考URL
微生物病研究所分子免疫制御分野(山崎研)
http://www.biken.osaka-u.ac.jp/laboratories/detail/7
用語説明
- FcRγ
シグナル伝達のために機能するアダプター分子。細胞内領域にITAMと呼ばれるシグナルモチーフを有し、受容体と会合することで細胞内に受容体からのシグナルを伝達する。
- Dectin-2とMincle
病原体センサー(自然免疫受容体)に属するC型レクチン受容体であり、病原体由来の糖鎖を認識する。本研究では結核菌の細胞壁を構成するLAM(リポアラビノマンナン)をDectin-2が、TDM(トレハロースジミコール酸)をMincleが認識することを利用して実験を進めた。
- サイトカイン
細胞から分泌される低分子タンパク質であり、サイトカイン受容体を介して細胞間の情報伝達を行う。本研究では免疫細胞の増殖・活性化に寄与するIL-2と炎症応答を惹起するTNFについて検討した。
- クロマチン
ゲノムDNAとタンパク質の複合体のことで、遺伝子発現の際にはクロマチン構造が緩み露出したDNA(=オープンクロマチン領域)に様々なタンパク質が近接できるようになる。
- 転写因子
DNA配列を認識し結合することで転写の開始や調節を行うタンパク質の総称。
