大腸炎の重症化を防ぐメカニズムを解明
E-NTPD8は、好中球の長期生存に必要なATPを分解する
研究成果のポイント
- 細胞外のアデノシン三リン酸 (ATP) がP2X4受容体を介して好中球の長期生存を誘導し、大腸炎を重症化させることを明らかにした
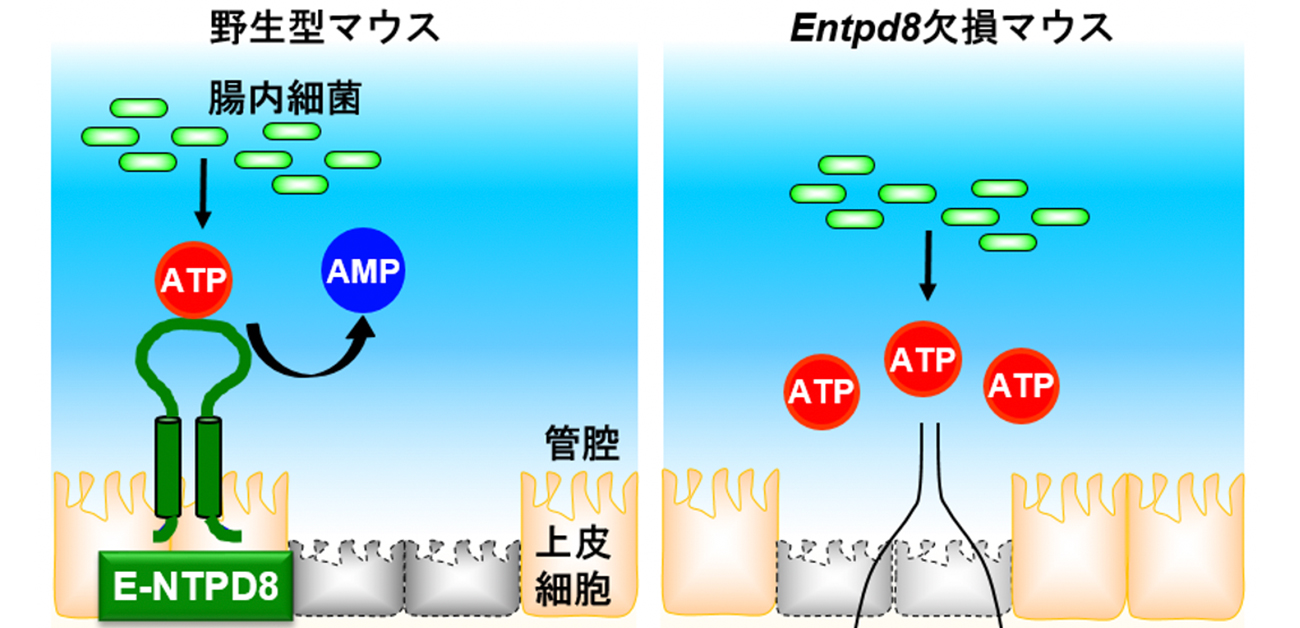
- 腸管上皮細胞に発現するタンパク分子E-NTPD8が腸内細菌から分泌されるATPを分解し、大腸炎の重症化を防ぐことを明らかにした
- 「細胞外ATP-P2X4受容体シグナルの制御」や「人為的E-NTPD8の発現制御」がヒトの潰瘍性大腸炎の治療につながることが期待される
概要
大阪大学高等共創研究院の香山尚子准教授(免疫学フロンティア研究センター兼任)、大学院医学系研究科の竹田潔教授(免疫学フロンティア研究センター兼任)らのグループは、E-NTPD8が腸内細菌から分泌されるATPによる大腸炎の重症化を防ぐために必須の分子であることを明らかにしました。
E-NPPおよびE-NTPDファミリー分子は、ATPをアデノシン二リン酸(ADP)やアデノシン一リン酸(AMP)に分解する酵素です。小腸では、E-NPP3やE-NTPD7による細胞外ATPの分解が正常な免疫系の維持に重要であることが報告されていました。しかし、大腸における細胞外ATPの制御機構とその役割は明らかになっていませんでした。
今回、研究グループは、
(1) 大腸上皮細胞に発現するE-NTPD8を欠損させたマウスでは、大腸内のATP濃度の上昇と好中球の増加が起こり、大腸炎が重症化すること
(2) 潰瘍性大腸炎患者の大腸上皮細胞ではE-NTPD8の発現が低下すること
(3) 細胞外ATPはP2X4受容体を介して好中球における解糖系を促進し、好中球の寿命を延伸すること
(4) P2X4受容体を欠損させたE-NTPD8欠損マウスでは、大腸炎の重症化が起こらないこと
を明らかにしました。
これらの結果より、「人為的E-NTPD8の発現制御」「大腸内の細胞外ATP-P2X4受容体シグナルの制御」が潰瘍性大腸炎の治療法開発につながることが期待されます。
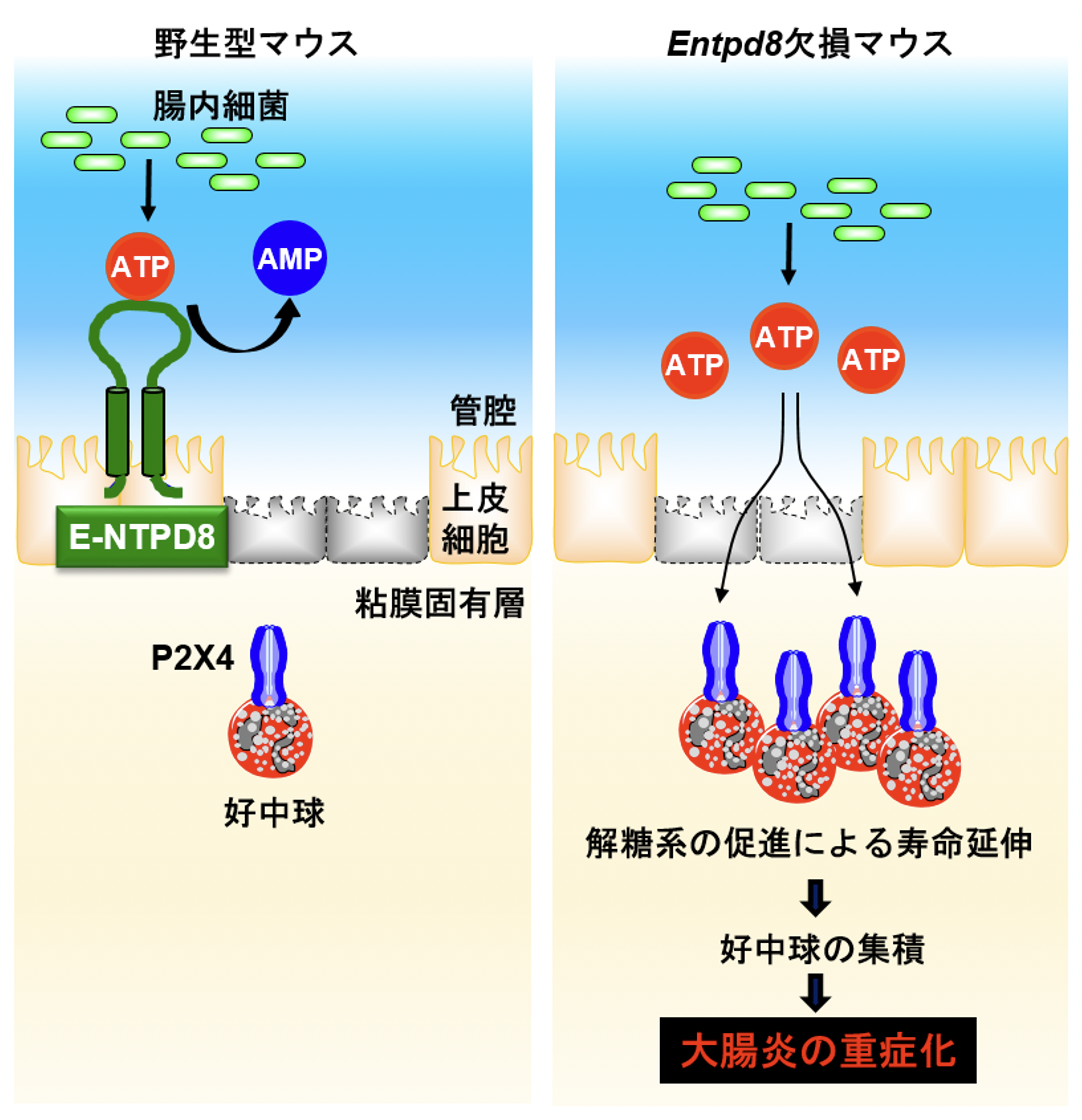
図 膜型ATP分解酵素E-NTPD8は、腸内細菌が分泌したATPを分解し、P2X4受容体を介した好中球の解糖系促進とそれに伴う寿命延伸を抑制する。このメカニズムは、上皮バリアの異常が起こった際、好中球の増加を原因とする大腸炎の重症化を防ぐために必須である。
研究の背景
大腸や小腸では、腸内細菌が生息する場(管腔)と免疫細胞が存在する場(粘膜固有層)は、上皮細胞が形成するバリアによって隔てられています。潰瘍性大腸炎は、大腸の粘膜に炎症や潰瘍が起こる難治性の疾患で、世界的に患者数が増加しています。「上皮バリアの異常」や「腸内細菌に対する免疫系の異常な活性化」が潰瘍性大腸炎の病態に関係していると考えられていますが、真の発症原因は分かっておらず、根本的な治療法は確立されていません。
腸内細菌や宿主細胞が分泌する細胞外ATPは、P2X/P2Y受容体を介して免疫細胞を活性化します。適切な免疫系の活性化は病原体の排除に役立ちますが、過剰な免疫応答は組織の破壊につながり、大腸炎の重症化の原因となります。そのため、腸管組織では、細胞外ATPの濃度は厳密に制御される必要があります。E-NPPおよびE-NTPDファミリー分子は、細胞膜や細胞小器官の膜に発現し、ATPをADPやAMPに分解する酵素です。小腸の上皮細胞に発現するE-NTPD7は、腸内細菌が分泌した細胞外ATPを分解し、Th17細胞 の増加を防いでいます。また、小腸に存在する肥満細胞 に発現するE-NPP3は食物アレルギーの予防に必須であることが報告されています。しかし、大腸における細胞外ATP分解を司る分子およびその異常が免疫系におよぼす影響は明らかになっていませんでした。
研究内容の詳細
研究グループは、マウスとヒトの正常な大腸の上皮細胞において膜型ATP分解酵素E-NTPD8が高発現すること、潰瘍性大腸炎患者の大腸上皮細胞ではE-NTPD8の発現が低くなっていることを見出しました。
通常のマウス(野生型マウス)とE-NTPD8を持たないマウス(Entpd8欠損マウス)の糞便に含まれるATPの濃度を測定しました(腸管内のATPの量を反映します)(図1A)。野生型マウスと比較して、Entpd8欠損マウスの糞便に含まれる細胞外ATPの量が極めて多いことが分かりました。また、抗生物質を飲ませて腸内細菌を死滅させたEntpd8欠損マウスと野生型マウスの糞便におけるATPの量に差はありませんでした。マウスにデキストラン硫酸ナトリウム(DSS)を含む水を飲ませて、潰瘍性大腸炎に似た腸炎を誘導すると、野生型マウスと比較してEntpd8欠損マウスでは腸炎の症状(下痢と血便)がひどくなることが示されました(図1B)。
DSSにより重篤な大腸炎を起こしたEntpd8欠損マウスでは、野生型マウスに比べて、大腸内の好中球(Ly6G陽性細胞)の数が顕著に増加していました(図2A)。DSSを飲ませた野生型マウスの大腸内の好中球では、細胞死を誘導する因子の一つであるcleaved caspase 3が検出されましたが、Entpd8欠損マウスの大腸好中球では、cleaved caspase 3は検出されませんでした(図2A)。さらに、anti-Gr1抗体を投与して腸内に好中球が存在しない状態にしたEntpd8欠損マウスでは、DSSによる大腸炎の重症化が起こりませんでした(図2B)。
分解されないATP(ATPgS)にさらされた大腸好中球では、細胞死の一種であるアポトーシスの起こる割合が低下することがわかりました(図3A)。また、細胞内の代謝経路の一つである解糖系を止める試薬2DGを加えるとATPgSによるアポトーシスの抑制は起こりませんでした(図3A)。野生型マウスの大腸内の好中球をATPgSにさらすと解糖系が活性化したことを示す細胞外酸性化速度の値が高くなりましたが、ATP受容体であるP2rx4 (P2X4受容体)が欠損したマウスの大腸好中球ではATPgSによる細胞外酸性化速度の上昇は起こりませんでした(図3B)。さらに、DSS投与後にEntpd8欠損マウスでみられる大腸内の好中球の増加と大腸炎の重症化は、P2rx4とEntpd8を共に欠損させた(Entpd8/P2rx4欠損)マウスでは起こりませんでした(図3C)。
これらの結果から、大腸上皮細胞に発現するE-NTPD8は、腸内細菌が分泌した細胞外ATPを分解することにより、好中球における解糖系の活性化とそれによる寿命延伸を抑制し、大腸炎の重症化を防ぐことが明らかとなりました。
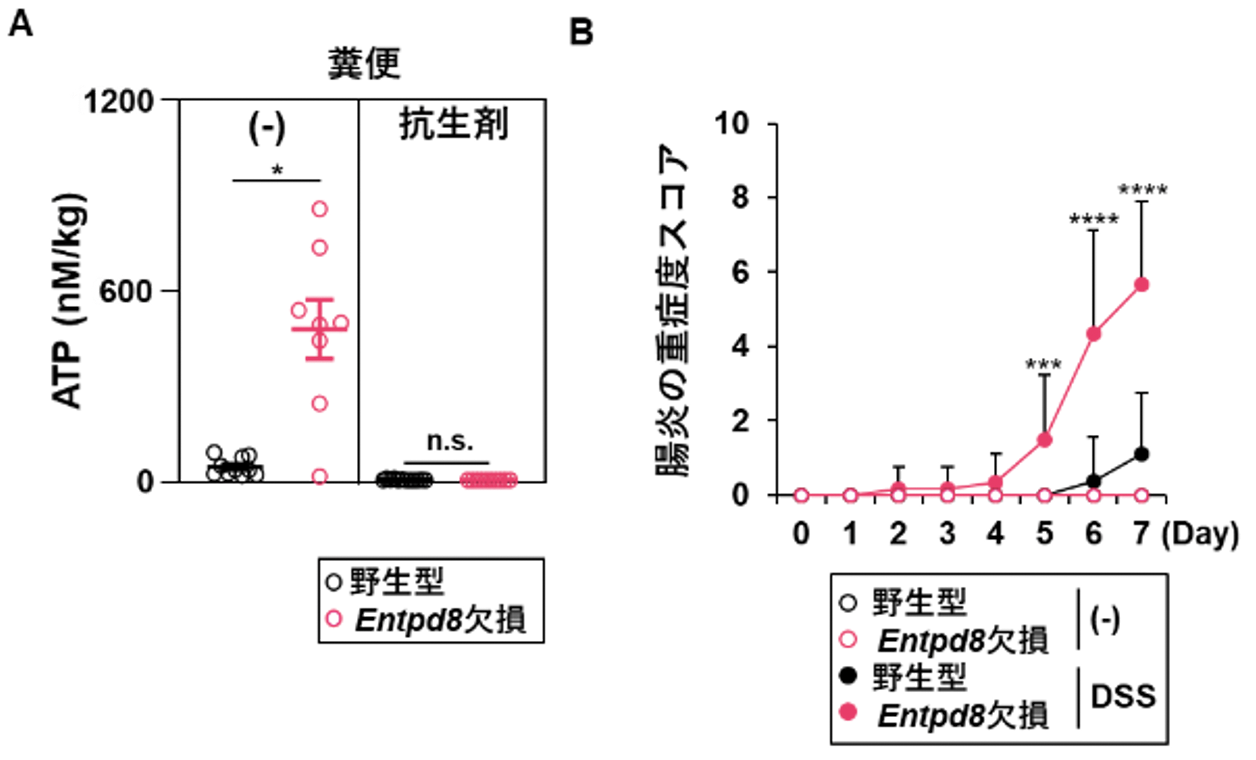
図1. E-NTPD8による腸内細菌由来ATP分解と腸管炎症の抑制
(A)抗生剤を投与して腸内細菌を除去したマウスと抗生剤投与マウスの糞便中のATP濃度を測定。
(B)3%のデキストラン硫酸ナトリウム(DSS)を含む水もしくは通常の水を自由飲水させたマウスにおける血便と下痢の重症後スコア(各項目:0-4)の合計を腸炎の重症度スコアとして表示。***p<0.05, ****p<0.001.
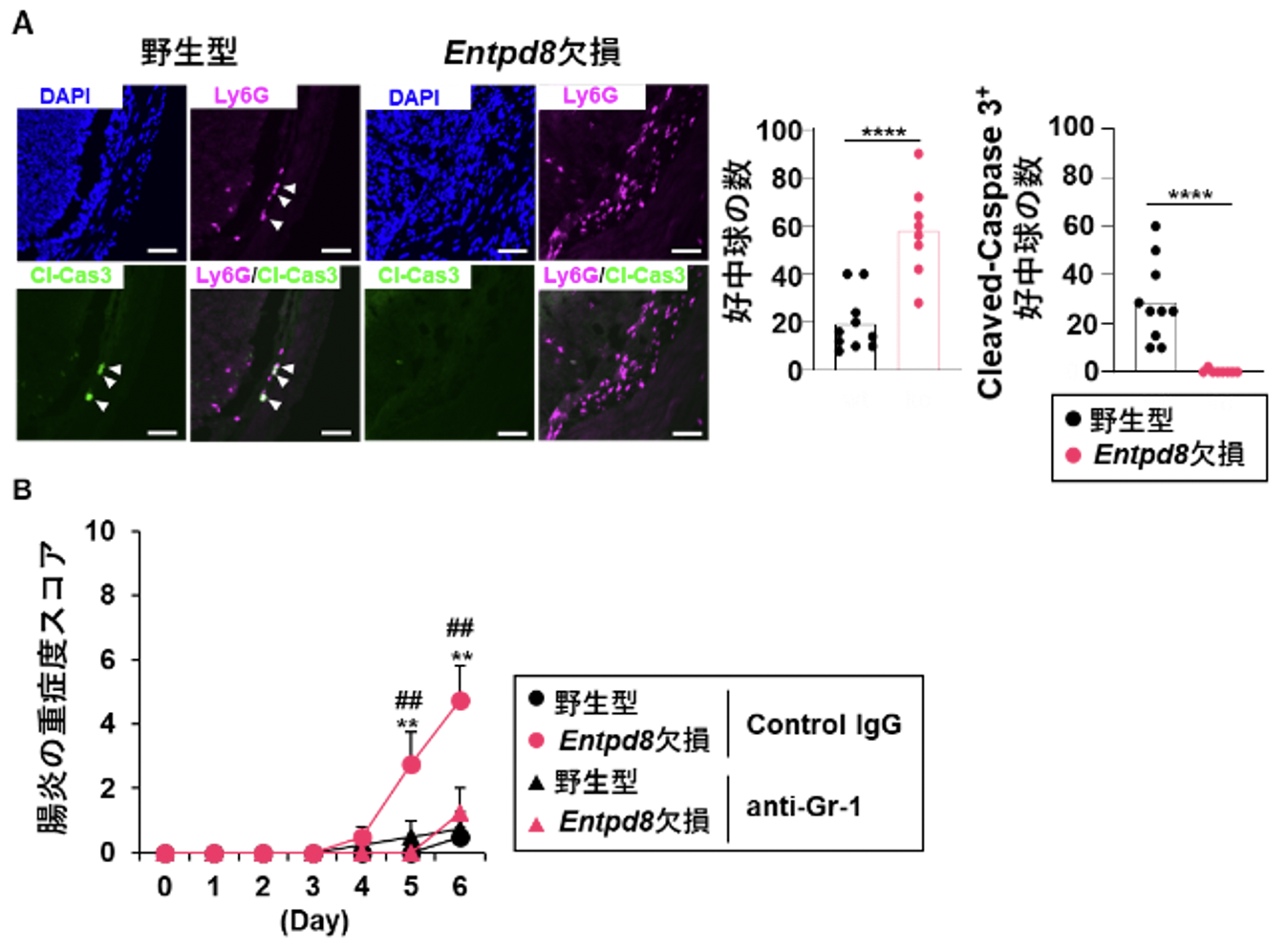
図2. E-NTPD8欠損による好中球増加を伴う大腸炎の重症化
(A)3%DSSを投与したマウスの大腸のパラフィン切片を用いて好中球に発現するLy6Gと細胞死を誘導するcleaved caspase3(Cl-Cas3)を免疫組織化学染色した像(左)。1視野あたりのLy6G陽性細胞(好中球)の数(真ん中グラフ)とcleaved caspase3陽性好中球の数(右グラフ)。****p<0.001.
(B)3%DSSを含む水を自由飲水させているマウスに好中球を除去するanti-Gr1抗体もしくはコントロールIgGを腹腔内に投与して腸炎の重症度スコアを解析した。**p<0.01,##p<0.01.*;コントロールIgG投与野生型マウスvsコントロールIgG投与Entpd8欠損マウス。#;コントロールIgG投与Entpd8欠損マウスvs anti-Gr1抗体投与Entpd8欠損マウス。
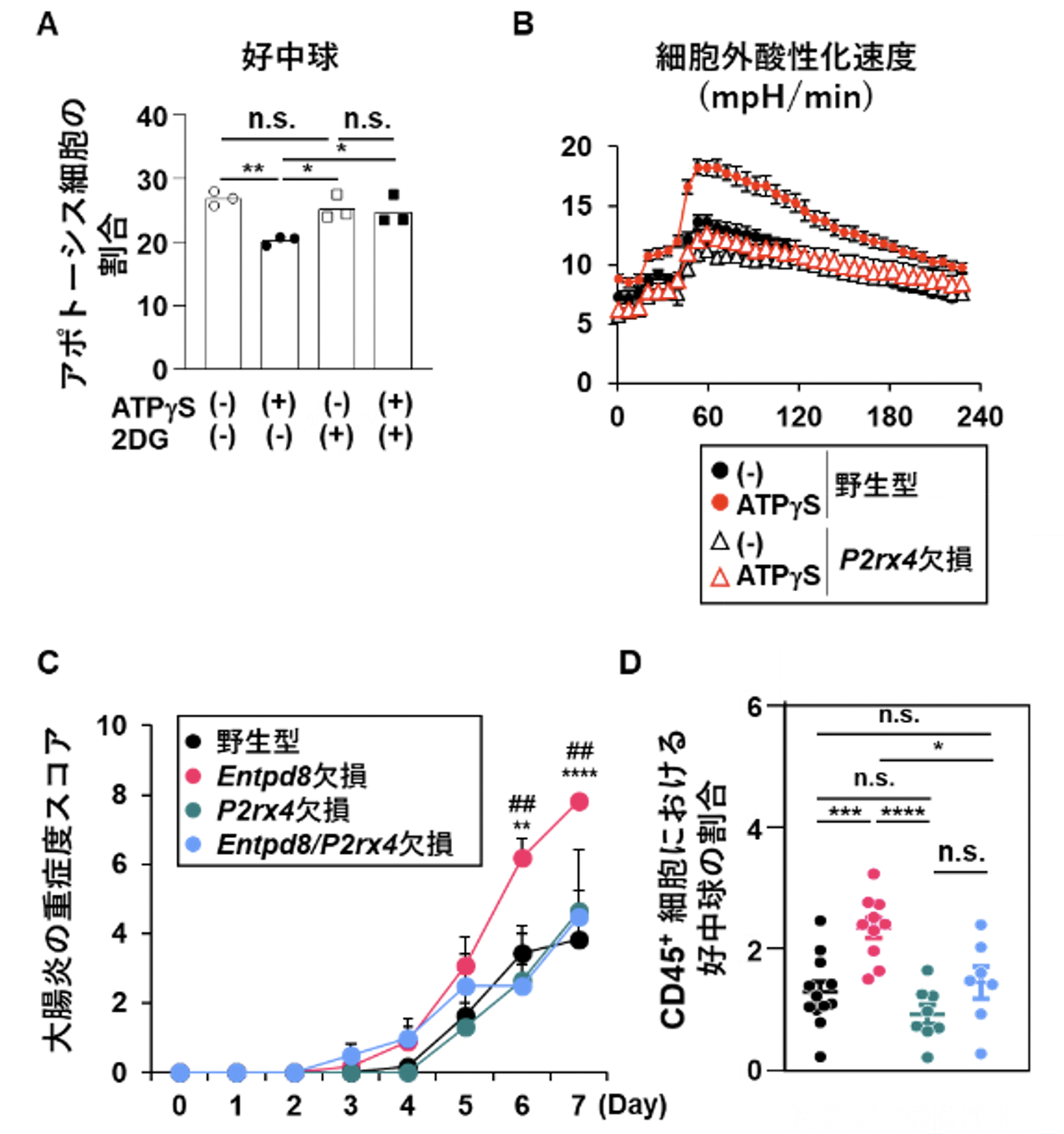
図3. 細胞外ATP-P2X4受容体シグナルによる解糖系活性化を介した細胞死抑制
(A)解糖系の阻害剤2DGとATPγSを添加もしくは未添加の条件で5時間培養した大腸好中球におけるアポトーシス細胞の割合。*p<0.05, **p<0.01.n.s.;not significant.
(B)3%DSSを含む水を自由飲水させたマウスの大腸から回収した好中球をATPγS添加もしくは未添加の条件で培養したのち解糖系活性化の指標である細胞外酸性化速度を測定。
(C)3%DSSを含む水を自由飲水させたマウスにおける大腸炎の重症度スコア(左)。3%DSS投与開始から7日後の大腸における好中球の数(右)。**p<0.01, ****p<0.001, ##p<0.01.*;野生型マウスvs Entpd8欠損マウス。#;Entpd8欠損マウスvs Entpd8/P2rx4欠損マウス。
本研究成果が社会に与える影響(本研究成果の意義)
潰瘍性大腸炎の患者数は、世界的に増加の一途をたどっており、症状に合わせた多様な治療法の開発が望まれています。本研究により、潰瘍性大腸炎患者の大腸上皮細胞では、好中球による腸炎の重症化を防ぐために必須であるE-NTPD8の発現が低下していることが明らかになりました。潰瘍性大腸炎では、大腸における好中球の増加が病態に深く関与することが報告されており、E-NTPD8や細胞外ATP-P2X4受容体シグナル経路が潰瘍性大腸炎の創薬標的となることが期待されます。
特記事項
本研究成果は、2021年9月21日(火)午前4時(日本時間)にProceedings of the National Academy of Sciences of the United States of America (PNAS) 米科学アカデミー紀要のオンライン版で公開されました。
【タイトル】
“The ATP-hydrolyzing ectoenzyme E-NTPD8 attenuates colitis through modulation of P2X4 receptor-dependent metabolism in myeloid cells”
【著者】
Haruka Tani#, Bo Li#, Takashi Kusu, Ryu Okumura, Junichi Nishimura, Daisuke Okuzaki, Daisuke Motooka, Shoya Arakawa, Asuka Mori, Terukazu Yoshihara, Takayuki Ogino, Shih-Han Tsai, Yoki Furuta, Masato Muneta, Shota Nakamura, Eiichiro Fukusaki, Kimiko Yamamoto, Hideo Yagita, Hisako Kayama, and Kiyoshi Takeda* (#; contributed equally, *; corresponding)
本研究は、2017年度日本学術振興会科学研究費助成事業基盤研究Cの一環で行われました。また、日本医療研究開発機構革新的先端研究開発支援事業PRIME:間葉系ストローマ細胞と免疫細胞の相互作用による腸管恒常性維持機構に関する研究開発 、日本医療研究開発機構革新的先端研究開発支援事業AMED-CREST:腸内微生物叢の宿主共生と宿主相互作用機構の解明、国立がん研究センターより支援を受けて実施されました。
用語説明
- アデノシン三リン酸 (ATP)
3分子のリン酸基をもつ、生体内に広く分布するヌクレオチド。細胞内で、リン酸を遊離したり会合したりすることにより、 エネルギーの放出・貯蔵に関わる。細胞外にも分布し、細胞間の信号伝達に関わることが明らかになっている。
- 好中球
自然免疫細胞の一種で、末梢血中で最も数の多い白血球。細胞質に分解酵素を含む顆粒を持つ貪食細胞で、細菌や真菌の感染に対して急性の炎症反応を起こし、生体を防御する。炎症時に好中球から放出される分解酵素は組織障害に影響を与える。
- 潰瘍性大腸炎
厚生労働省により難病に指定されている疾患。大腸に炎症と潰瘍が生じる疾患であり発症原因は解明されていない。上皮バリアの異常や腸内細菌に対する免疫応答が制御できないことが病態に関与すると考えられている。
- 解糖系
細胞内に取り込んだグルコース(糖)をピルビン酸に変換する経路。1分子のグルコースから2分子のATPが産生され、中間代謝産物である核酸、アミノ酸、脂肪酸などは細胞構成成分の合成に利用される。
- Th17細胞
サイトカインIL-17A, IL-17F, IL-22を産生する獲得免疫細胞CD4+ Tリンパ球の一種。好中球を活性化する。細胞外の真菌や細菌を排除する生体防御に必須の細胞であるが、自己免疫疾患や炎症性疾患の発症や重症化にも関わる。
- 肥満細胞
アレルギーを引き起こす血液系細胞。高親和性 IgE 受容体(FcεRI)を細胞表面に発現し、抗原(アレルゲン)と会合した IgE が結合すると、様々な化学伝達物質を放出して、アレルギーを引き起こす。全身の組織に分布する。
