無用の長物と考えられていた虫垂の免疫学的意義を解明
炎症性腸疾患の制御に繋がる新たな分子機構
概要
大阪大学大学院医学系研究科感染症・免疫学講座(免疫制御学)/免疫学フロンティア研究センターの竹田潔教授らのグループは、私たちの体で不必要な組織と考えられていた虫垂に存在するリンパ組織が、粘膜免疫で重要な役割を果たすIgA の産生に重要な場であり、腸内細菌叢 の制御に関与していることを突き止めました。本研究グループは、実験的に虫垂リンパ組織を欠如したマウスを作成したところ、このマウスでは大腸のIgA産生細胞の数が減少し、大腸の腸内細菌叢が変化することを見出しました。IgAは腸内細菌叢の維持に重要な抗体であることから、虫垂は腸内細菌叢のバランス異常によって発症する炎症性腸疾患 の制御にも関わる重要な組織であると考えられます。今後、虫垂を標的とした炎症性腸疾患への新たな治療法の開発が期待されます。
本研究成果は、2014年4月10日(英国時間10時)に英国科学誌「Nature Communications」のオンライン版で公開されます。

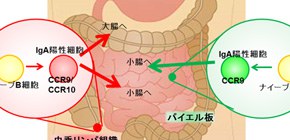
図 虫垂リンパ組織は、大腸および小腸に動員されるIgA産生細胞を作り出し、大腸の腸内細菌叢の維持に必要なリンパ組織であることが明らかになった。
研究の背景
右下腹部の盲腸から細く伸びる虫垂は、長く私たちの体にとって必要な組織とは考えられておらず、炎症(虫垂炎)を起こしやすいことから、開腹手術の際に切除してしまうこともある組織です。しかし、虫垂には、リンパ球 の集まった場所(虫垂リンパ組織)があり、何らかの免疫学的機能を有している可能性が考えられていました。
研究グループは、まず、虫垂リンパ組織の構造を、典型的な腸管関連リンパ組織のパイエル板 と比較して解析しました。どちらのリンパ組織も、免疫細胞の配置などが同じように観察され、同じような免疫誘導組織であることが予想されました( 図1 )。そこで、虫垂リンパ組織の機能を調べるため、虫垂切除マウスを作成しました。免疫系が発達していない無菌マウス の虫垂を手術で切除し、その後、腸内細菌を定着させることにより免疫系の発達を調べました。すると、虫垂を切除したマウスでは、大腸でIgA産生細胞の数の増加が顕著に遅れていることが判明しました( 図2 )。IgAは、腸内細菌叢のバランスの維持を担うことが知られています。そこで、虫垂切除マウスと虫垂を持つマウスの大腸の腸内細菌叢を調べたところ、虫垂切除マウスでは、大腸型の腸内細菌叢のパターンを示さないことが判明しました。
次に、虫垂リンパ組織およびパイエル板のIgA陽性細胞がどこに向かうのかを調べたところ、虫垂リンパ組織のIgA陽性細胞は小腸と大腸に移動するのに対して、パイエル板のIgA陽性細胞は大腸にも移動するものの、主に小腸に移動することが判明しました( 図3 )。
小腸および大腸へのリンパ球の動員はケモカインと呼ばれる液性因子により制御されており、小腸へはCCR9ケモカイン受容体、大腸などの粘膜組織にはCCR10ケモカイン受容体が、それぞれ移動を担っています。そこで、虫垂リンパ組織およびパイエル板のIgA陽性細胞の両ケモカイン受容体の発現を調べました。その結果、パイエル板のIgA陽性細胞はCCR9を発現するがCCR10の発現は弱いこと、一方、虫垂リンパ組織のIgA陽性細胞はCCR9およびCCR10を発現することが判明しました。
本研究の結果より、パイエル板は主に小腸に動員されるIgA陽性細胞を産生するリンパ組織であるのに対して、虫垂リンパ組織は小腸および大腸に動員されるIgA陽性細胞を産生する場所であることが明らかになりました。そして虫垂がなくなることにより、大腸の腸内細菌叢のバランスが崩れることが明らかになりました。
本研究成果が社会に与える影響(本研究成果の意義)
本研究では、虫垂リンパ組織が大腸に動員されるIgA陽性細胞を産生する場であることを明らかにしました。さらに、虫垂がなくなると、大腸の腸内細菌叢のバランスが崩れることも明らかにしました。
近年、腸内細菌叢の変化に伴い、腸管感染症に対する感受性が亢進することや、炎症性腸疾患が発症することが報告されています。IgAは、腸内細菌叢のバランスの維持に極めて重要な抗体です。本研究により、長年ないがしろにされてきた虫垂が、大腸に動員されるIgA陽性細胞の産生を司る場であることが明らかになりました。虫垂の切除による炎症性腸疾患発症感受性の変化も報告されています。今後、虫垂リンパ組織の重要性を念頭においた腸管免疫系の制御法が開発されることにより、炎症性腸疾患や腸管感染症の治療に繋がることが期待されます。
特記事項
本研究は、独立行政法人科学技術振興機構(JST)の戦略的創造研究推進事業チーム型研究(CREST)研究領域:「アレルギー疾患・自己免疫疾患などの発症機構と治療技術」(研究総括:菅村和夫宮城県立病院機構理事長)研究課題名:「自然免疫系を標的とした腸管免疫疾患の制御技術の開発」研究代表者:竹田 潔(大阪大学医学系研究科教授)の一環として行いました。また、本研究は、大阪大学、東京大学、近畿大学、理化学研究所との共同で行ったものです。
本研究成果は、2014年4月10日(英国時間10時)に英国科学誌「Nature Communications」のオンライン版で公開されます。
論文タイトル “Generation of colonic IgA-secreting cells in the cecal patch”
(虫垂リンパ組織は大腸に動員されるIgA産生細胞を作り出す)
参考図
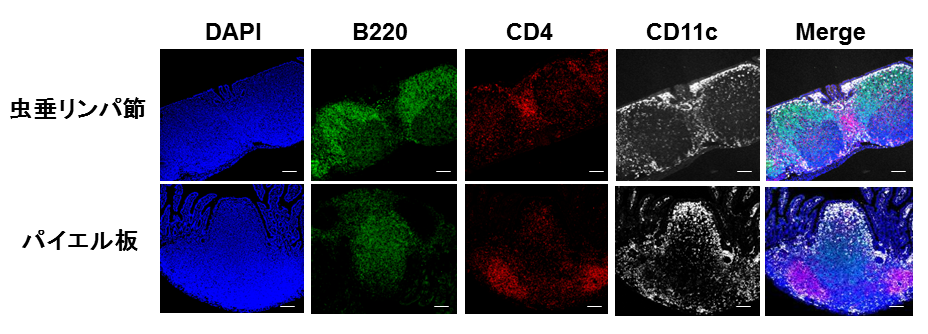
図1 虫垂リンパ組織とパイエル板の構造
マウスの虫垂リンパ組織およびパイエル板の切片を、Bリンパ球(B220:緑)、Tリンパ球(CD4:赤)、樹状細胞(CD11c:白)に対する抗体および核(DAPI:青)で染色した。両リンパ組織とも、Bリンパ球集簇、Tリンパ球集簇、樹状細胞集簇が同様に認められた。
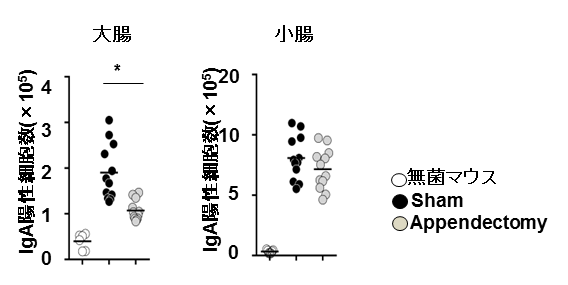
図2 虫垂切除マウスの大腸、小腸におけるIgA陽性細胞数
開腹のみ(Sham)あるいは虫垂を切除(Appendectomy)した無菌マウスに腸内細菌を定着させ、4週間後に大腸および小腸組織のIgA産生細胞数を解析した。開腹のみのマウスに比べて、虫垂切除マウスでは、大腸のIgA陽性細胞数が減少していることが分かった。
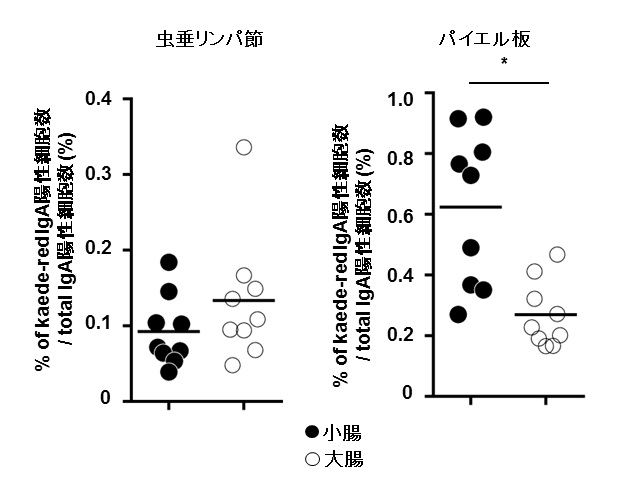
図3 虫垂リンパ組織、パイエル板のIgA陽性細胞の行先
虫垂リンパ組織とパイエル板のIgA陽性細胞を蛍光タンパク質(Kaede-red)で標識し、7日後に、大腸および小腸組織の蛍光タンパク質陽性のIgA陽性細胞の数を測定した。虫垂リンパ組織のIgA陽性細胞は、大腸および小腸組織に動員された。一方、パイエル板のIgA陽性細胞は、主に小腸組織に動員された。
参考URL
大阪大学 大学院医学系研究科感染症・免疫学講座 免疫制御学教室
http://www.med.osaka-u.ac.jp/pub/ongene/index.html
用語説明
- IgA
免疫グロブリン(抗体)の一種。消化器や呼吸器などの粘膜組織では、IgAが抗体の大半をしめており、粘膜組織での免疫応答の主役となる。IgGなどの抗体は細菌に会合すると免疫応答を活性化するが、IgAは細菌に会合しその運動性を弱める。
- 腸内細菌叢
腸内には100種類以上、100兆個以上の腸内細菌が生息しており、宿主であるヒトや動物の栄養分の一部を利用しながら、他の腸内細菌とバランスを取って一種の生態系を形成していることから、この生態系を腸内細菌叢と呼ぶ。
- 炎症性腸疾患
免疫細胞の異常と腸内細菌叢の変化が相まって発症する免疫疾患で、潰瘍性大腸炎やクローン病などがある。
- リンパ球
免疫応答を担う免疫細胞の一種。Tリンパ球、Bリンパ球からなり、抗原を認識し活性化され、その抗原を排除する。
- パイエル板
小腸に存在する代表的な腸管関連リンパ組織。腸管内の抗原を取り込み、IgA産生細胞の誘導など、腸管における免疫誘導を担う場所である。
- 無菌マウス
腸内細菌叢もない全身まったく無菌のマウス。特殊なビニルアイソレーターで飼育される。このマウスでは、Bリンパ球やTリンパ球の発達が正常に誘導されない。
