アレルギー反応を抑えるメカニズムを解明
喘息や皮膚アレルギーの新たな治療薬開発に期待
本研究成果のポイント
概要
大阪大学大学院医学系研究科感染症・免疫学講座(免疫制御学)/免疫学フロンティア研究センターの竹田潔教授らのグループは、喘息や、アトピーなどの皮膚アレルギーを引き起こすマスト細胞・好塩基球 の活性を抑えるメカニズムを突き止めました。
近年患者数が増加の一途をたどる喘息やアトピーなどのアレルギー疾患は、マスト細胞・好塩基球によって引き起こされることが知られています。しかし、マスト細胞・好塩基球の活性が普段どのように制御されているかについてはわかっていませんでした。
本研究にて、アレルゲン で活性化された好塩基球で発現が高くなる酵素E-NPP3 (CD203c)を欠損したマウスを作成したところ、マスト細胞・好塩基球が活性化状態になり、皮膚アレルギー、食物アレルギー、喘息が悪化することを見出しました。また、E-NPP3 はアデノシン三リン酸(ATP) を分解する膜型酵素であり、ATPのアレルギーへの関与を調べたところ、アレルゲンで活性化されたマスト細胞・好塩基球はATPを分泌し、分泌されたATPがマスト細胞・好塩基球自身をさらに活性化、アレルギーを悪化させることが明らかになりました。今後、ATP、 E-NPP3を標的とした喘息や皮膚アレルギーへの新たな治療法の開発が期待されます。
本研究成果は、2015年2月17日(米国東部時間12時)に米国科学誌「Immunity」のオンライン版で公開されました。
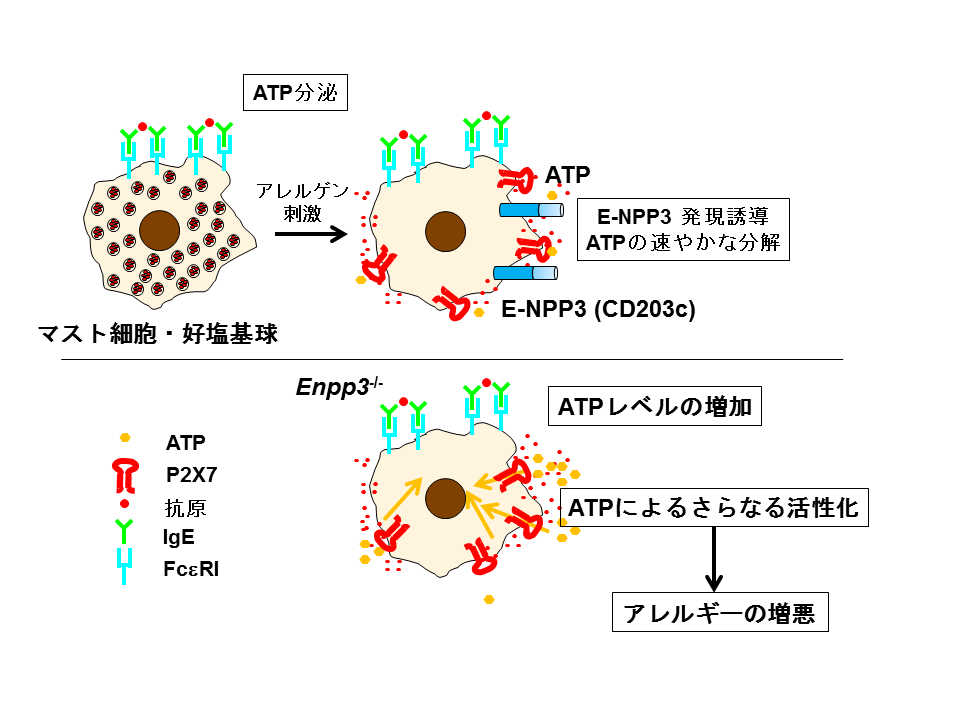
図:マスト細胞・好塩基球はアレルゲンにさらされるとATPを分泌する。それと同時に、ATP分解酵素であるE-NPP3 (CD203c)が細胞膜上に発現し、速やかにATPを分解し、ATPによるアレルギーの悪化を防ぐことが明らかになった。
研究の背景
近年患者数が増加の一途をたどる喘息やアトピーなどのアレルギー疾患は、マスト細胞・好塩基球によって引き起こされることが知られています。実際、アレルギー患者では、マスト細胞・好塩基球が活性化されています。しかし、普段どのようにマスト細胞・好塩基球の活性が制御されているかについてはわかっていませんでした。
研究グループは、アレルゲンによって活性化されたマスト細胞・好塩基球で発現が高くなるE-NPP3 (CD203c)に着目しました。E-NPP3を欠損するマウスを作製すると、このマウスではマスト細胞・好塩基球の数が増加するとともに活性化状態にありました (図1) 。E-NPP3がATP分解酵素であることから、血中ATP濃度を測定すると、このマウスではATP濃度が増加していることが判明しました。また、E-NPP3を欠損するマウスでは、皮膚アレルギー、食物アレルギー、喘息が重症化しました (図2) 。
次に、マスト細胞・好塩基球の機能を調べたところ、アレルゲン刺激によりATPを分泌すること、E-NPP3欠損細胞では、ATPの分解が進まないためATP濃度が高くなること、さらにATPがマスト細胞・好塩基球自身に作用し、さらに活性化させアレルギー炎症を誘導することが判明しました。
ATPはP2受容体群を介して細胞に作用しますが、P2受容体のひとつであるP2X7を欠損させると、E-NPP3欠損マスト細胞・好塩基球の活性が減弱し、その数も減少しました (図3) 。
本研究の結果より、マスト細胞・好塩基球は、アレルゲン刺激によって活性化され、ATPを分泌します。分泌されたATPは自身を分泌した細胞に作用し、さらに活性化してアレルギー反応を誘導するが、アレルゲン刺激によってATP分解酵素であるE-NPP3 (CD203c)が細胞膜上に発現するため、分泌されたATPを速やかに分解し、過剰なアレルギー反応を抑えています。
本研究成果が社会に与える影響(本研究成果の意義)
本研究では、E-NPP3がATP依存性のマスト細胞・好塩基球によるアレルギー反応を抑えることを明らかにしました。近年、喘息、アトピーなどのアレルギー疾患が増加の一途をたどっています。今後、ATP, E-NPP3を標的としてマスト細胞・好塩基球の活性を制御することにより、アレルギーの新たな治療薬の開発に繋がることが期待されます。
特記事項
本研究は、独立行政法人科学技術振興機構(JST)の戦略的創造研究推進事業チーム型研究(CREST)研究領域:「アレルギー疾患・自己免疫疾患などの発症機構と治療技術」(研究総括:菅村和夫宮城県立病院機構理事長)における研究課題:「自然免疫系を標的とした腸管免疫疾患の制御技術の開発」研究代表者:竹田潔(大阪大学大学院医学系研究科教授)の一環として行いました。また、本研究は、大阪大学、東京大学、東京医科歯科大学との共同で行ったものです。
また、本研究成果は、2015年2月17日(米国東部時間12時)に米国科学誌「Immunity」のオンライン版で公開されました。
論文タイトル
“The ectoenzyme E-NPP3 negatively regulates ATP-dependent chronic allergic responses by basophils and mast cells”
(E-NPP3は、マスト細胞・好塩基球によるATP依存性のアレルギー反応を負に制御する)
参考図
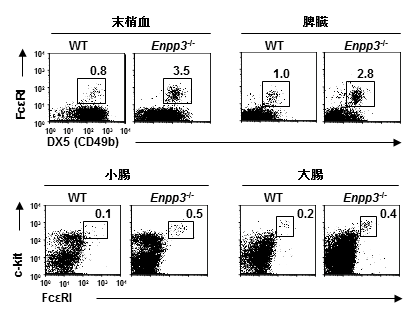
図1 E-NPP3欠損マウスは皮膚アレルギーや喘息に対する感受性が亢進する
正常マウス(WT)およびE-NPP3欠損マウス(Enpp3-/-)の末梢血および脾臓の好塩基球と小腸および大腸のマスト細胞の数。E-NPP3欠損マウスで、好塩基球とマスト細胞数の増加が認められた。
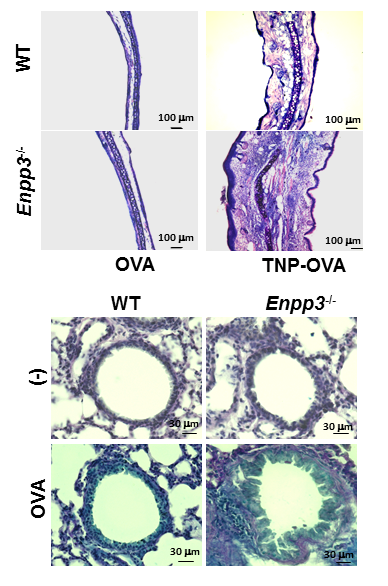
図2 ボツリヌス毒素複合体(血清型A型)は、腸管上皮中に存在するM細胞と呼ばれる特殊な細胞を主な侵入部位として、体内に取り込まれ、食中毒を引き起こすことが明らかになりました。
(上段)正常マウス(WT)およびE-NPP3欠損マウス(Enpp3-/-)に抗TNP-IgEを静脈内投与し、1日後にアレルゲン(TNP-OVA)を右耳に投与し、4日後にヘマトキシリン・エオジン染色により組織解析した。E-NPP3欠損マウスでは、皮膚アレルギーの増悪が認められた。
(下段)正常マウス(WT)およびE-NPP3欠損マウス(Enpp3-/-)にアレルゲン(OVA/Alum)を2度腹腔内投与し、7日後から6度OVAを経鼻投与した。最終投与後に、肺をアルシアン・ブルーおよびヘマトキシリン染色により組織解析した。E-NPP3欠損マウスでは、粘液産生亢進とともに炎症細胞の間質への浸潤が顕著に認められた。
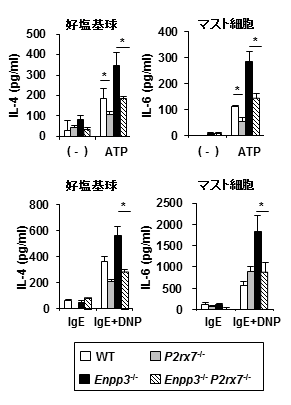
図3 好塩基球とマスト細胞のサイトカイン産生
正常マウス(WT)、E-NPP3欠損マウス(Enpp3-/-)、P2X7欠損マウス(P2xr7-/-)、および二重欠損マウス(Enpp3-/- P2xr7-/-)の骨髄由来好塩基球およびマスト細胞をATPあるいはアレルゲン(IgE+DNP)で刺激し、IL-4あるいはIL-6 の産生を解析した。E-NPP3欠損マウスではサイトカインの産生が亢進したが、Enpp3-/- P2xr7-/-マウスでは、正常化した。
参考URL
大阪大学 大学院医学系研究科感染症・免疫学講座 免疫制御学教室
http://www.med.osaka-u.ac.jp/pub/ongene/index.html
用語説明
- マスト細胞
アレルギーを引き起こす血液系細胞。高親和性IgE受容体(FcεRI)を細胞表面に発現し、抗原(アレルゲン)と会合したIgEが会合すると、様々な化学伝達物質を放出して、アレルギーを引き起こす。全身の組織に分布する。
- 好塩基球
マスト細胞と同様にアレルギー反応を引き起こす血液系細胞。全身の組織に分布するマスト細胞と異なり、血液中に存在する。
- アレルゲン
アレルギーを引き起こす抗原。IgEにより認識される。
- アデノシン三リン酸(ATP)
3分子のリン酸基をもつ、生体内に広く分布するヌクレオチド。細胞内で、リン酸を遊離したり会合することにより、エネルギーの放出・貯蔵に関わる。細胞外にも分布し、細胞間の信号伝達に関わることが近年明らかになっている。
- IL-4
IL-4, IL-6は、サイトカインの一種であり、産生されると炎症反応を促す。
