多発性骨髄腫に対する新規「CAR-T細胞療法」を開発
インテグリンβ7の活性型立体構造を標的とした免疫療法
研究成果のポイント
・多発性骨髄腫細胞では恒常的にインテグリンβ7が活性化していることを発見した。
・インテグリンβ7の活性型立体構造を標的としたCAR-T細胞が骨髄腫特異的細胞傷害を持つことを示した。
・がんに特異的な「タンパク質の“かたち”」を標的としたがん免疫療法の可能性を示した。
概要
大阪大学大学院医学系研究科の保仙直毅准教授(呼吸器・免疫内科学、保健学科癌幹細胞制御学)、熊ノ郷淳教授(呼吸器・免疫内科学)および蛋白質研究所の高木淳一教授(分子創製学)らの研究グループは、多発性骨髄腫(以下、“骨髄腫”と言う)において、活性型の構造を有するインテグリンβ7 が特異的に高発現し、がん免疫療法の一つであるCAR-T細胞療法 の標的になり得ることを発見しました。
骨髄腫は代表的な血液がんの一つで、治療の進歩は著しいものの、未だに治癒は極めて困難です。免疫療法であるCAR-T細胞療法は、極めて強力な新規治療法として注目を集めています。CAR-T細胞療法を開発するためには、がん細胞には発現しているが、正常細胞には発現していない“がん特異的抗原”が必要です。本研究グループは、骨髄腫細胞では正常血液細胞と異なり、インテグリンβ7というタンパク質の多くが常時活性化した状態にあり、活性型構造をとった時にのみ露出する抗原が骨髄腫特異的抗原となり得ることを発見しました。さらに、それを標的としたCAR-T細胞が骨髄腫に対して著明な抗腫瘍効果を持つことを示しました。
これらの発見により、本研究グループは、骨髄腫に対する新しい免疫療法の開発に成功したのみならず、タンパク質自体ががん特異的でなくとも、タンパク質のがん特異的な“かたち”ががんの治療標的となり得るという新たな知見を提示しました (図1) 。
本研究成果は、「Nature Medicine」に、11月7日(火)午前1時(日本時間)に公開されました。
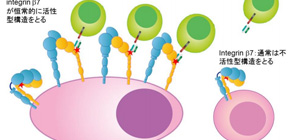
図1 インテグリンβ7の活性型立体構造を標的としたMMG49 CAR-T細胞療法
骨髄腫細胞においてはインテグリンβ7が高発現している上に、その多くが常に活性化した状態にある。一方、正常のリンパ球にもインテグリンβ7は発現しているが、ほとんどの場合不活性型構造をとる。活性型構造でのみ露出する部位(左図、赤い星印部分)を標的にしたCAR-T細胞により骨髄腫細胞を特異的に攻撃することが可能である。
研究の背景
骨髄腫は、抗体を産生する細胞である形質細胞 が腫瘍化した血液がんで、日本における患者数は約1万8千人と言われています。近年の治療の進歩は著しいものの、未だに治癒は極めて困難であり、新たな治療薬の開発が待ち望まれています。
がん免疫療法として注目されているCAR-T細胞療法は、治癒を目指した治療として有望であると考えられています。CAR-T細胞療法では、がん細胞に特異的な細胞表面抗原を標的とします。リンパ性白血病においてはCD19というタンパク質が標的として用いられ、驚異的な治療効果が報告されました。同じ血液がんである骨髄腫に対しても同様の治療の開発が望まれますが、そのためには骨髄腫細胞においてのみ発現している細胞表面抗原を見つけることが必要でした。しかし、骨髄腫細胞でのみ働いている遺伝子やタンパク質の探索はすでに世界中で徹底的に行われ、新規治療標的の同定は極めて困難と考えられておりました。
そこで、研究グループは、骨髄腫細胞に結合するモノクローナル抗体 を多種類作製し、新たな抗原を探すところから研究をスタートしました。
本研究の成果
研究グループは、骨髄腫細胞に結合するモノクローナル抗体10,000クローン以上の中から、骨髄腫細胞には結合するが正常血液細胞には結合しない抗体として、MMG49という抗体を同定しました。次に、骨髄腫細胞において、MMG49が結合しているタンパク質がインテグリンβ7であることを明らかにしました。不思議なことに、正常な血液細胞にもインテグリンβ7タンパクは発現しているにもかかわらず、MMG49は正常血液細胞には結合しませんでした。
インテグリンというタンパク質は活性化に伴い立体構造が変化することが知られています。そこで、より詳細に解析したところ、MMG49は活性型立体構造をとったインテグリンβ7のみに結合することがわかりました。さらに、ほとんどの正常血液細胞ではインテグリンβ7は不活性型構造で存在するのに対し、骨髄腫細胞では多くのインテグリンβ7が恒常的に活性化型構造の状態にあることを見出しました。また、インテグリンβ7は血液細胞以外の組織では発現が見られないので、活性化インテグリンβ7を認識するMMG49は特異的に骨髄腫細胞に結合します。そこで、MMG49の抗原認識部位を持つCAR-T細胞を作製しました。マウスを用いた実験において、MMG49由来CAR-T細胞は正常細胞を傷害せずに、骨髄腫細胞のみを特異的に排除することを示しました (図2) 。
図2 MMG49 CAR-T細胞の著明な抗腫瘍効果
光の強さが腫瘍量を反映している。コントロールT細胞投与群(図右)では、腫瘍量の経時的な増加もしくはマウスの死亡が認められるが、MMG49 CAR-T細胞を投与した群(図左)では腫瘍量の増加が見られず、MMG49 CAR-T細胞による著明な抗腫瘍効果が認められた。
本研究成果が社会に与える影響(本研究成果の意義)
これらの結果は、活性型インテグリンβ7を標的としたMMG49 CAR-T細胞療法が骨髄腫に対する有望な新規免疫療法であることを示しており、現在、医師主導治験(AMED革新的がん医療実用化研究事業)の準備が進められています。
さらに重要なことは、タンパク質自体ががんに特異的でなくても、その立体構造にがん特異的なものがあれば、その“がん特異的立体構造”を標的とした免疫療法が可能であることを示したことにあり、今後、他の多くのがん種において同様の“がん特異的立体構造”が治療標的として同定されることが期待されます。
図3 CAR-T細胞療法の概要
特記事項
本研究成果は、2017年11月7日(火)午前1時(日本時間)に「Nature Medicine」(オンライン)に掲載されました。
【タイトル】
“The activated conformation of integrin β7 is a novel multiple myeloma–specific target for CAR T-cell therapy ”
【著者名】
Naoki Hosen 1-3* , Yukiko Matsunaga 4,20 , Kana Hasegawa 1,20 , Hiroshi Matsuno 5 , Yuki Nakamura 1 , Mio Makita 1 , Kouki Watanabe 1 , Mikako Yoshida 1 , Kei Satoh 1 , Soyoko Morimoto 6 , Fumihiro Fujiki 7 , Hiroko Nakajima 7 , Jun Nakata 6 , Sumiyuki Nishida 2 , Akihiro Tsuboi 6 , Yoshihiro Oka 1-3 , Masahiro Manabe 8 , Hiroyoshi Ichihara 9 , Yasutaka Aoyama 9 , Atsuko Mugitani 9 , Takafumi Nakao 10 , Masayuki Hino 11 , Ryosuke Uchibori 12 , Keiya Ozawa 12,13 , Yoshihiro Baba 14 , Seitaro Terakura 15 , Naoki Wada 16 , Eiichi Morii 16 , Junichi Nishimura 5 , Kiyoshi Takeda 3,17,19 , Yusuke Oji 18 , Haruo Sugiyama 7 , Junichi Takagi 4 , Atsushi Kumanogoh 2,3,19 (*責任著者)
【所属】
1 大阪大学大学院医学系研究科 呼吸器・免疫内科学, 2 大阪大学免疫学フロンティア研究センター 感染病態学, 3 大阪大学大学院医学系研究科(保健学科)癌幹細胞制御学, 4 大阪大学蛋白質研究所 分子創製学, 5 大阪大学大学院医学系研究科 消化器外科学, 6 大阪大学大学院医学系研究科 癌ワクチン療法学, 7 大阪大学大学院医学系研究科 癌免疫学, 8 大阪鉄道病院血液内科, 9 府中病院血液内科, 10 大阪市立総合医療センター 血液内科, 11 大阪市立大学大学院医学系研究科 血液腫瘍内科学, 12 自治医科大学免疫遺伝子細胞治療学, 13 東京大学医科学研究所, 14 九州大学 生体防御医学研究所 分子機能制御学部門, 15 名古屋大学大学院医学系研究科 血液腫瘍内科学, 16 大阪大学大学院医学系研究科 病態病理学, 17 大阪大学大学院医学系研究科 免疫制御学, 18 大阪大学大学院医学系研究科(保健学科)機能診断科学, 19 AMED-CREST.( 20 同等貢献)
本研究課題は、国立研究開発法人日本医療研究開発機構(AMED)の次世代がん研究シーズ戦略的育成プログラムにおける研究開発課題「がん幹細胞を標的とした新規抗体療法の開発」(研究開発代表者:保仙直毅)、革新的がん医療実用化研究事業における研究開発課題「新規骨髄腫特異的抗原を標的としたCAR-T細胞療法の開発」(研究開発代表者:保仙直毅)、および革新的先端研究開発支援事業(AMED-CREST)の研究開発領域「炎症の慢性化機構の解明と制御に向けた基盤技術の創出」における研究開発課題「慢性炎症におけるガイダンス因子の病的意義の解明とその制御」(研究開発代表者:熊ノ郷淳)の一環として行われました。なお、次世代がん研究シーズ戦略的育成プログラムおよびAMED-CREST研究開発領域は、平成27年4月のAMEDの発足に伴い、それぞれ文部科学省および国立研究開発法人科学技術振興機構(JST)より移管されたものです。
研究者のコメント<保仙准教授>
多発性骨髄腫に対する新しい免疫療法を開発しました。現在、準備中の医師主導治験により、それが本当に患者さんに恩恵を与えうるものであるかを明らかにします。また、網羅的解析による治療標的探索では同定し得ない治療標的を同定し、“がんに特異的な立体構造”を標的とすることが可能であることを示せたことにより、今後、様々ながん種において新たな治療標的の探索に役立つのではないかと期待しています。
参考URL
大阪大学大学院医学系研究科 免疫造血制御学研究室
http://sahswww.med.osaka-u.ac.jp/~hmtonc/index.html
大阪大学大学院医学系研究科 呼吸器・免疫アレルギー内科学 呼吸器内科 感染病態グループ
http://www.med.osaka-u.ac.jp/pub/imed3/immunopathology/index.html
大阪大学蛋白質研究所附属蛋白質解析先端研究センター 分子創製学研究室
http://www.protein.osaka-u.ac.jp/rcsfp/synthesis/
用語説明
- インテグリンβ7
細胞表面の膜に存在し、細胞外の基質や他の細胞との接着のために必要なタンパク質である、インテグリンファミリータンパクの一つ。
- CAR-T細胞療法
CAR-T(カーティー)細胞療法はBリンパ性悪性腫瘍に対するその驚くべき効果により、世界中の注目を集めるようになった新しい免疫療法。がんに特異的に結合する抗体の抗原認識部位とCD28およびCD3というT細胞受容体のシグナルを伝える分子の融合体であるCARを患者のT細胞に発現させることにより作製されたCAR-T細胞は、抗体のように特異的かつ強く標的に結合することにより活性化され、強い細胞傷害活性を発揮するだけでなく、どんどん増殖するので、非常に強い抗腫瘍活性を示す (図3) 。
- 形質細胞
血液細胞の一種で、抗体を産生する細胞。Bリンパ球が、細菌やウイルスなどの異物を見つけると形質細胞となり、抗体を産生する。異常な形質細胞(骨髄腫細胞)は、異物を攻撃する能力を持たない抗体をつくる。
- モノクローナル抗体
抗原には多数の抗原決定基(エピトープ)があり、通常、免疫した動物から1つの抗原を認識する抗体を集めると、いろいろな抗原決定基を認識する抗体が混ざった状態で集められる(ポリクローナル抗体)。それに対し、特定の抗原決定基だけと結合する抗体の集合体をモノクローナル抗体という。
