「コロナ制圧タスクフォース」 COVID-19患者由来の血液細胞における遺伝子発現の網羅的解析
重症度に応じた遺伝子発現の変化には、ヒトゲノム配列の個人差が影響する
概要
新型コロナウイルス(SARS-CoV-2)感染症(COVID-19)の脅威に立ち向かうため、2020年5月に異分野の専門家による共同研究グループ「コロナ制圧タスクフォース」(参考1、参考2)が立ち上がりました。このたび、王青波准教授(大阪大学大学院医学系研究科)を中心とした研究グループは、COVID-19患者さん465名(うち重症/最重症者 359名)の血液細胞における遺伝子発現及びそのヒトゲノム配列の個人差との関連を調べる網羅的な解析を実施しました。
解析により、遺伝子発現を制御する原因変異として1,169のヒトゲノム変異が精緻に推定(fine-mapping)されました。その原因変異は遺伝的集団やCOVID-19の感染状況に依らず、欧米での先行研究と高い一致率を示すことがわかりました。また、COVID-19の重症度とゲノム変異による遺伝子発現制御の相互関係の解析(ieQTL解析)により、重症度に応じた遺伝子発現の変化パターンが特定ヒトゲノム変異の有無で異なる遺伝子(例: CLEC4C:補足1)が存在することが明らかにされました。さらに、その仕組みが、いくつかの細胞種に特異的な遺伝子発現により説明できることがわかりました。これらの結果は、感染する可能性を、特定遺伝子の細胞種に特異的な制御の仕組みの違いとして理解するためのさらなる考察につながると考えられます。
本研究成果は、2022年8月22日(英国時間)に国際科学誌Nature Communicationsオンライン版に掲載されました。今後もコロナ制圧タスクフォースは、新型コロナウイルスと闘う患者さん、診療の最前線に立つ医療従事者と共に、新型コロナウイルス感染症の克服、そして未来のパンデミックに備える社会の公器として、引き続き活動を続けていきます。
図1. 全国に広がるコロナ制圧タスクフォースのネットワーク
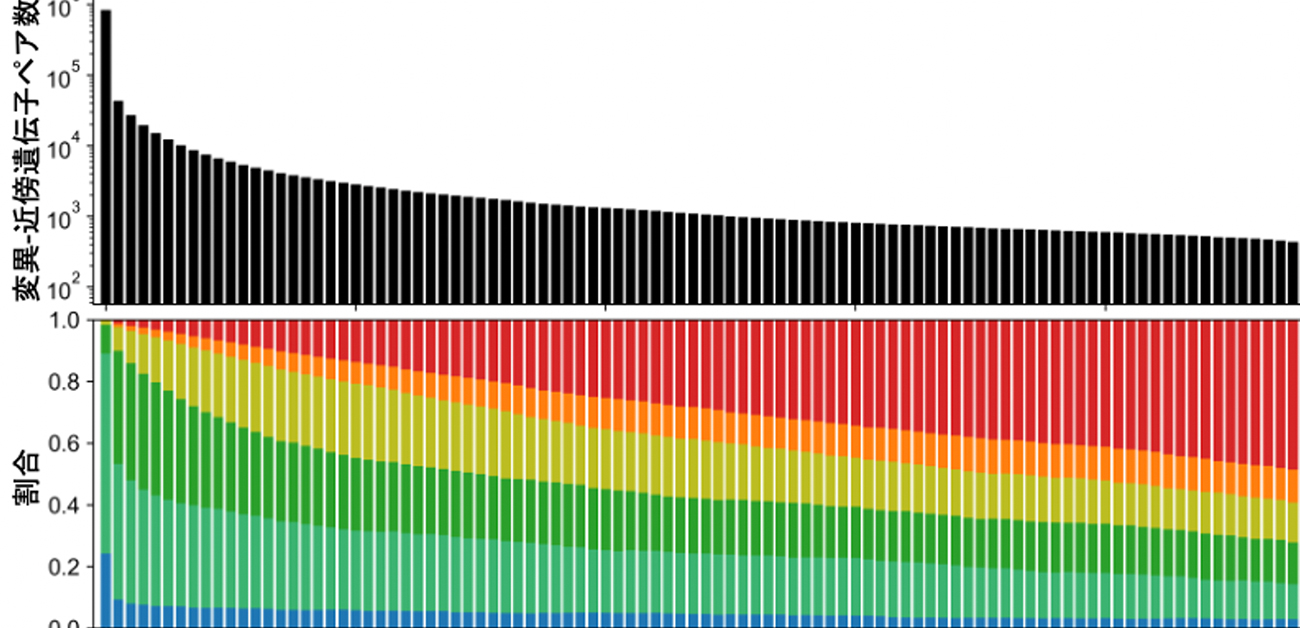
遺伝子発現を制御するゲノム上原因変異の網羅的同定
個人間でのヒトゲノムの配列の違い、つまり特定のゲノム変異の有無により、身長や疾患リスク等の形質のみならず、遺伝子の発現量にも差が見られることが知られています。今回、大阪大学大学院医学系研究科の王青波准教授を中心とする研究グループは、COVID-19患者さん465名(うち重症/最重症者 359名)由来の血液細胞における遺伝子発現及びヒトゲノム配列の個人差を合わせて解析することで、COVID-19患者さん465名の血液細胞における遺伝子発現制御の全体像を提示しました。これには、
- 近傍遺伝子の発現を制御する原因変異として1,169のゲノム変異を精緻に推定
- うち、遺伝子発現制御を介して血球量等の形質に深く関わると推定される変異群の同定
- 遠方遺伝子の発現を制御する51,516の原因変異候補の推定
- 近傍遺伝子のイントロン切断を制御する原因変異として1,549のゲノム変異を精緻に推定
が含まれます。結果を欧米での先行研究(GTEx)と比較することで、原因変異は遺伝的集団や、COVID-19の感染状況に依らず、高い一致率を示すことがわかりました。日本人集団において、あるいはCOVID-19感染者集団において、遺伝子発現変化に深く関わるゲノム変異を一変異レベルで精緻にかつ網羅的に同定した先行研究は限られているため、今回の結果はリソースとしての価値が認められます。
図2. 血液細胞における遺伝子発現制御の全体像を解析した結果、遺伝子発現を制御する原因変異が精緻に推定され、欧米での先行研究と高い一致率を示した。
重症度に応じた遺伝子発現パターン変化を解明
次に研究グループは、COVID-19患者さん465名(うち重症/最重症者 359名) に関して、軽症/無症状者と重症/最重症者の間で遺伝子発現を比較し、COVID-19重症化を特徴付ける遺伝子発現変化の探索を試みました。その結果、既報により重症化のマーカーとして報告されるCD177やFOXC1を含む、198遺伝子の発現量が有意に増加している様子が認められました。さらに、これら遺伝子の多くは好中球顆粒の放出等、自然免疫に強く関わる機能と関連が深いことがわかりました。
図3. 重症及び最重症者での遺伝子発現量が明らかに増加する遺伝子群が同定され、その多くが自然免疫に関わる機能を有する
重症度に応じた遺伝子発現変化には、ヒトゲノム配列の個人差が影響する
さらに、ここまで確認された個人間でのゲノム変異の有無による遺伝子発現量の違いと、重症度に応じた遺伝子発現の変化、この両者の間の関連を調べるために、重症度とゲノム変異の両者をモデルに組み込んだ遺伝子発現解析を行いました。その結果13の遺伝子に関して、重症度に応じた遺伝子発現の変化は、ゲノム変異の有無という個人差に起因することが認められました。例えば、CLEC4Cという遺伝子においては、rs11055602変異を持たない集団では重症度に応じて発現量が低下するのに対し、変異を有する集団では逆に重症度に応じて発現量が増加することがわかりました。また、各個人における血液細胞内の細胞種割合の推定を行った結果と組み合わせて解析することで、こうした現象の多くは遺伝子発現の細胞種特異性により説明されうることがわかりました。
図4. CLEC4C遺伝子の発現量の重症化に応じた変化は、特定ゲノム変異(rs11055602)の有無で異なる。同様に重症度に応じた発現量変化がゲノム変異の有無で異なる13の遺伝子が同定された。それぞれ、推定された種々の細胞種比率との相互作用が確認された。
今後の展開
今回の研究では、アジア最大のCOVID-19のバイオリソースの一つと言えるコロナ制圧タスクフォースで得られた、COVID-19患者さん465名の血液細胞における遺伝子発現データを分析しました。具体的には、遺伝子発現を制御するヒトゲノム変異、重症度に応じた遺伝子発現パターンの変化、及び、両者の間の相互作用の大規模な分析が行われました。分析の結果は、血液細胞における遺伝子発現制御の全体像を提供し、感染する可能性を、特定遺伝子の細胞種に特異的な制御の仕組みの違いとして理解するためのさらなる考察につながると考えられます。コロナ制圧タスクフォースでは、集積された検体のタンパク質発現量の解析や、一細胞レベルでの遺伝子発現解析をはじめとする多層的な解析が進行中です。この先、これら多層的オミクスデータを統合することで、今回の全血遺伝子発現データの解析では観測できない希少細胞種における特異的な免疫応答等、より詳細な生命機構の仕組みの理解が期待されます。
特記事項
【論文情報】
英文タイトル:The whole blood transcriptional regulation landscape in 465 COVID-19 infected samples from Japan COVID-19 Task Force
タイトル和訳:コロナ制圧タスクフォース由来COVID-19患者465名の血液細胞における遺伝子発現制御全体像
著者名:Wang, Q.S. et al.
掲載誌:Nature Communications(オンライン)
DOI:10.1038/s41467-022-32276-2
本研究は、国立研究開発法人日本医療研究開発機構(AMED)創薬支援推進事業「新型コロナウイルス感染症(COVID-19)に対するワクチン開発」「新型コロナウイルス感染症の遺伝学的知見に基づいた分子ニードルCOVID-19粘膜免疫ワクチンの開発」(研究代表者:金井隆典 慶應義塾大学医学部 内科学(消化器)教授)、新興・再興感染症に対する革新的医薬品等開発推進研究事業「新型コロナウイルス感染症の重症化阻止を目指した医薬品・次世代型ワクチン開発に必要な遺伝学・免疫学・代謝学的基盤研究の推進」(研究代表者:福永興壱 慶應義塾大学医学部 内科学(呼吸器)教授)、新興・再興感染症に対する革新的医薬品等開発推進研究事業「新型コロナ変異ウイルスに対する遺伝学的、免疫学的、代謝学的病態解明および治療戦略の策定」(研究代表者:福永興壱 慶應義塾大学医学部 内科学(呼吸器)教授)、新興・再興感染症研究基盤創生事業(多分野融合研究領域)「新型コロナウイルス感染症後遺症の病態生理の多分野融合による解明」(研究開発代表者:石井誠 慶應義塾大学医学部 内科学(呼吸器)准教授(研究当時、現在:名古屋大学大学院医学系研究科 教授))国立研究開発法人科学技術振興機構(JST) 戦略的創造研究推進事業CREST「先端ゲノム解析と人工知能によるコロナ制圧研究(JPMJCR20H2)」(研究代表者:井元清哉 東京大学医科学研究所附属ヒトゲノム解析センター教授)、さきがけ「パンデミックに対してレジリエントな研究体制構築のための基盤研究(JPMJPR21R7)」(研究代表者:南宮湖 慶應義塾大学医学部感染症学教室専任講師)、大阪大学免疫学フロンティア研究センター(IFReC)、大阪大学感染症総合教育研究拠点(CiDER)の支援を受けました。
また、イーパーセル株式会社の北野譲治様を始めとする本研究プロジェクトにご賛同いただいた寄付者からの寄付金を基に実施されました。データ解析において東京大学医科学研究所ヒトゲノム解析センターのスーパーコンピュータ「SHIROKANE」を利用しました。
参考
(参考1)2022年8月9日プレスリリース
「コロナ制圧タスクフォース」
COVID-19疾患感受性遺伝子DOCK2の重症化機序を解明
-アジア最大のバイオレポジトリーでCOVID-19の治療標的を発見-
https://www.keio.ac.jp/ja/press-releases/2022/8/9/28-126102/
(参考2)コロナ制圧タスクフォースHP
https://www.covid19-taskforce.jp/
用語説明
- 新型コロナウイルス(SARS-CoV-2)
新型コロナウイルス感染症の原因となるウイルスのことを表します。2002年に流行したSARSコロナウイルスとウイルスが似ているため、SARS-CoV-2と命名されました。
- 新型コロナウイルス感染症(COVID-19)
coronavirus disease 2019(2019年に発生した新型コロナウイルス感染症)を略した言葉で、新型コロナウイルスによる病気のことを表します。2019年の終わり頃に、中国・武漢を中心に発生したのを皮切りに、その後、世界中に感染が拡大しました。新型コロナウイルスに感染すると、発熱や咳、息苦しさといった症状が出て、感染が肺に及び肺炎を発症すると呼吸困難に陥ります。
- 遺伝子発現
遺伝子の情報が細胞における構造および機能に変換される過程のことです。高速シークエンサーを用いてRNAのシーケンシング(配列情報の決定)を行い定量した、細胞内で発現するmessenger RNA(mRNA)量を各遺伝子に関する遺伝子発現量として定義しています。mRNAとは、遺伝子が持っている遺伝情報のコピーです。生命現象の中で重要な働きをするタンパク質の設計図は遺伝子にありますが、遺伝子から直接タンパク質を合成することはできません。mRNAにコピーされた情報をリボソームと呼ばれる粒子が翻訳することによってタンパク質が作られます。
- ヒトゲノム配列の個人差
遺伝子とは、親から子へ体をつくるときの特徴を伝えるための1つ1つの情報のことで、生命現象の中で重要な働きをするタンパク質の設計図です。ゲノムとは、使わない情報も含んだすべての遺伝情報のことです。ヒトゲノム配列には個人差が存在することが知られ、ゲノム変異と呼ばれます。
- fine-mapping
一般に形質に関連するゲノム変異は複数存在し、そのうち原因となる変異は少数であることがわかっています。多数の関連する変異から最も原因らしい変異群を統計的に推定することを(statistical) fine-mappingと呼びます。
- 遺伝的集団
英語におけるpopulation、すなわちある遺伝学的背景が同じ任意の集団(データから科学的に定義された任意の集団)を、本研究においては日本語訳の一例として「遺伝的集団」と呼んでいます。
- ieQTL
interaction-expression quantitative loci、すなわち、相互作用を有して遺伝子発現制御に関わるゲノム変異のことを指します。本研究では主に、COVID-19重症度との相互作用をモデルに組み込んだ解析を行いました。
- イントロン
mRNAのうち、最終的にタンパク質には翻訳されず、スプライシングと呼ばれる過程により除去される部分を指します。スプライシング過程に関しても近傍ゲノム変異の有無による個人差が認められます。
