世界初!寄生虫「トキソプラズマ」に対する免疫反応が大幅アップ!
抗トキソプラズマ免疫反応のブレーキ役を果たす分子の同定
リリース概要
大阪大学微生物病研究所の山本雅裕教授(免疫学フロンティア研究センター兼任)らの研究グループは、RabGDIα(ラブ ジーディーアイ アルファ)と呼ばれる宿主(しゅくしゅ)分子 が、病原性寄生虫「トキソプラズマ」に対する宿主免疫反応を抑制しており、RabGDIαの阻害によってトキソプラズマに対する免疫反応が大幅にアップすることを発見しました。
研究の背景
トキソプラズマは寄生虫の一種です。ヒトには主にトキソプラズマが感染している肉を加熱不十分で食することによって感染し、エイズや抗癌剤治療下にある免疫不全患者に致死性の脳症や心筋炎を引き起こす他、妊婦が初感染すると流産または新生児の先天性疾患の原因になり、わが国でも症例数が増加しています。
トキソプラズマに対してわれわれ宿主はインターフェロン ガンマに依存した免疫反応を起こし対抗しますが、その免疫反応がどのように抑制(ブレーキ)されているのかについては全く不明でした。
本研究成果が社会に与える影響(本研究成果の意義)
本研究では、次のことを示しました。
①インターフェロン ガンマによって誘導されるトキソプラズマを破壊する免疫反応が、宿主からRabGDIαを取り除くことによって著しく増強され、その結果、トキソプラズマ原虫数が少なくなること
②通常よりも多い原虫数のトキソプラズマ感染でも、RabGDIα欠損マウスは生存率が高く、致死的な脳症の程度が軽いこと
③RabGDIαに存在する脂質結合ポケット(タンパク質の「穴」)が、そのブレーキ機能に必須であること
本研究成果は、RabGDIαの機能を阻害することによってトキソプラズマに対する免疫機能が大幅に増強し、トキソプラズマ脳症の重症度が改善されたことから、近年我が国においても症例報告が急増しているトキソプラズマ症に対して、RabGDIαという新たな分子を標的とした新規治療戦略を提供できるものとして大いに期待できます。
特記事項
本研究成果は、米国の科学雑誌 『Proceedings of the National Academy of Science of the USA (PNAS)』(米国科学アカデミー紀要)にオンライン掲載されました(8月3日付け:日本時間8月4日午前4時)。
研究の詳細な説明
背景
寄生虫「トキソプラズマ」は原虫(単細胞の寄生虫)の一つであり、世界人口の約3割に感染しているとされています。免疫機能が正常な健常人ではトキソプラズマに感染してもほとんど症状はありませんが、エイズや抗癌剤投与下のガン患者あるいは免疫抑制剤を投与されている臓器移植患者などの免疫不全者において致死性の脳症や肺炎を引き起こします。トキソプラズマのヒトへの感染はそのほとんどが、トキソプラズマが感染している家畜の肉あるいはトキソプラズマに汚染された水や野菜等を加熱不十分あるいは非加熱で食べることによって起こる経口的経路で起こります。ユッケやレバ刺しなどの爆発的流行や、衛生状態が管理されていない野生の鳥獣(ジビエ)に由来する肉などを、生食あるいは加熱不十分な状態で意識・無意識にかかわらず食する機会が増えている我が国にあって、妊婦が初感染した際に胎盤を通じて胎児に感染し、流産や死産あるいは感染したまま新生児が生まれ水頭症や網脈絡膜炎などを主症状とする先天性トキソプラズマ症を発病している例が近年マスコミなどでも取り上げられています。(詳しくは、先天性トキソプラズマ&サイトメガロウイルス患者会「トーチの会」のホームページ http://toxo-cmv.org/ を参照してください。)以上のように、日本では病原性寄生虫「トキソプラズマ」に対する社会的注目が集まりつつあります。
トキソプラズマは我々宿主の体の中において、マクロファージなどの免疫細胞の中に「寄生胞」と呼ばれる膜状の特殊な構造体を作って感染して増殖しています (図1) 。トキソプラズマの細胞内感染に対して宿主の体では免疫反応が起き、細胞レベルで排除します。最も重要な因子はインターフェロン ガンマ(IFN-γ)と呼ばれるサイトカイン であり、IFN-γが誘導する様々なタンパク質群が寄生胞(の膜)に蓄積した上で寄生胞を破壊してトキソプラズマを細胞内で殺傷していることが近年の研究から分かってきました。一般的に、病原体や異物を排除する様々な免疫反応にはそれぞれブレーキの機能を持つタンパク質などによる負の抑制制御メカニズムが存在すると考えられています。しかし、IFN-γ誘導性のトキソプラズマに対する免疫反応で何がブレーキ役を果たしているのかについては、これまで全く分かっていませんでした。
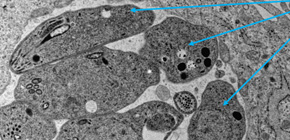
図1 「寄生胞」に包まれたトキソプラズマの電子顕微鏡写真
宿主の細胞の細胞質 (細胞の中)に感染し、寄生胞内に存在しているトキソプラズマの電子顕微鏡写真
研究の手法と成果
山本雅裕教授らの研究グループは、2012年に発表したトキソプラズマ寄生胞の破壊に関与するIFN-γ誘導性タンパク質群であるGBPの一つであるGbp2に結合するタンパク質を検索した結果、RabGDIα(ラブ ジーディーアイ アルファ)と呼ばれるタンパク質を免疫沈降・質量分析法 で同定しました (図2A) 。次にRabGDIαの生体内での役割を検討する目的で、マクロファージや好中球 などで特異的にRabGDIαを欠損するマウスを作製しました。RabGDIα欠損マウス由来のマクロファージではIFN-γ刺激によって起こる免疫反応(トキソプラズマ原虫数の低下)が、対照群と比較して、より増強しており原虫数はさらに減少していました (図2B) 。
次に対照マウス群が耐えることができず30日程度で死亡する高力価(通常よりも多い原虫数)のトキソプラズマをRabGDIα欠損マウスに感染させ経時的に生存率を測定した結果、RabGDIα欠損マウス群では有意に生存期間が延長し最終な生存率も対照マウス群に比べて高いことがわかりました (図3A) 。また20日後の各臓器中のトキソプラズマの原虫数を比較した結果、RabGDIα欠損マウス群では脳における原虫数が有意に少なかったことから、RabGDIα欠損マウスではトキソプラズマ脳症が抑制された結果、生存率が上昇していることが示唆されました (図3B) 。
次にRabGDIα欠損細胞で、どのようなメカニズムによってIFN-γ依存的な原虫数低下の増強が起こっているかを調べてみました。トキソプラズマの寄生胞を破壊するタンパク質群として知られているIFN-γ誘導性GTP分解酵素「IRGとGBP」の寄生胞への動員を検討した結果、IRGの一つであるトキソプラズマ寄生胞破壊タンパク質Irga6とGBPの一つであるGbp2の寄生胞への動員率が、RabGDIα欠損細胞では対照群に比較して有意に高いことを見出しました (図4A) 。またGbp2とIrga6の関係が不明であったことから、Gbp2欠損細胞を作製しIFN-γ刺激によるIrga6の寄生胞への動員率を検討したところ、Gbp2欠損細胞では野生型細胞に比べて低かったことから、Gbp2はIrga6のトキソプラズマ寄生胞への動員を補助である(すなわち、Gbp2はIrga6にとってはアクセルの役割を果たす)ことがわかりました (図4B) 。以上のことから、RabGDIαはGbp2を介して間接的にIrga6のトキソプラズマ寄生胞の動員を負に制御している(RabGDIαはGbp2のブレーキ役であり、Gbp2にブレーキがかかるために、結果としてIrga6のトキソプラズマへの動員が抑えられる)ということが示唆されました。
最後に、RabGDIαのどの部位がRabGDIαのブレーキ機能に重要であるかを検討しました。RabGDIαのタンパク質の構造をコンピューター上で予測した結果、ポケットが存在することが分かりました (図5A) 。このポケットには以前に別のグループの研究からRab(ラブ)と呼ばれるタンパク質の脂質鎖が入ることが知られていました。Gbp2もRabと同様に脂質鎖が修飾されることから、私達の研究グループはRabGDIαのポケットにGbp2の脂質鎖が入れないように改変することによって、RabGDIαのGbp2に対するブレーキ機能が阻害されるのではないかと考え、ポケットに位置するM132(132番目のメチオニン)をイソロイシンに置換したM132I変異体を作製し、Gbp2との結合とIFN-γ刺激後のトキソプラズマ原虫数を検討しました。その結果、RabGDIαのM132I変異体はGbp2との結合能を失い (図5B) 、さらに、野生型RabGDIαの過剰発現によるIFN-γ刺激によるトキソプラズマ原虫数の増大(RabGDIαによるブレーキ反応)がRabGDIαのM132I変異体の過剰発現では認められなかったことから、RabGDIαの脂質結合ポケットがそのブレーキ機能に重要であることがわかりました (図5C) 。
以上のことから、本研究によりRabGDIαがGbp2に結合し、Irga6の働きを間接的に細胞レベルで抑制していること、さらにRabGDIαを欠損するマウスの解析からRabGDIαがGbp2依存的な抗トキソプラズマ免疫反応を個体レベルで抑制していることが明らかとなりました (図6) 。
今後の期待
本研究で、世界で初めて、インターフェロン ガンマによる抗トキソプラズマ免疫反応にも負の抑制制御メカニズムがあり、RabGDIαがその中心的なブレーキ機能を果たすことを報告しました。さらにこの研究では、RabGDIαの機能を阻害することによってトキソプラズマ感染に対する免疫反応が増大した結果、個体レベルでトキソプラズマ脳症発病を抑制でき生存期間・生存率が大幅に改善できることを発見しました。この知見から、インターフェロン ガンマ依存的抗トキソプラズマ免疫反応のブレーキ分子・RabGDIαの機能阻害によって、致死的なトキソプラズマ症の発病を食い止める新規の治療・予防戦略を提供できることが期待されます。
掲載論文・雑誌
2015年8月4日(火)午前4時 オンライン掲載 (米国・東部時間: 8月3日午後3時)
Ohshima J, Sasai M, Liu J, Yamashita K, Ma JS, Lee Y, Bando H, Howard JC, Ebisu S, Hayashi M, Takeda K, Standley DM, Frickel EM, Yamamoto M.
『RabGDIα is a negative regulator of interferon-γ-inducible GTPase-dependent cell-autonomous immunity to Toxoplasma gondii』 Proc Natl Acad Sci U S A.
参考図

図2 Gbp2結合タンパク質RabGDIαを欠損するとIFN-γ依存的免疫反応が増強する
(A)RabGDIαはGbp2とは結合するが(赤枠)、Gbp1とは結合しないことから、RabGDIαのGbp2の結合は特異的である。(B)野生型細胞に比べて、RabGDIα欠損細胞ではIFN-γ刺激後の原虫数が野生型細胞よりも10倍以上少ない。

図3 RabGDIα欠損マウスは高力価トキソプラズマ感染に耐性であり、特に脳での原虫数が少ない
(A) 野生型マウスが30日余りで全数死亡するような高力価のトキソプラズマ感染でも、RabGDIα欠損マウスは30%程度生き残る。(B)感染後20日における各臓器の原虫数を測定した結果、脳での原虫数が少ないことから、脳症が軽度であることが分かる。

図4 RabGDIα欠損細胞では、トキソプラズマ寄生胞を破壊するタンパク質群の動員率が増加する
(A) RabGDIα欠損細胞は野生型細胞に比べて、Gbp2とIrga6の動員率が増加している。これはRabGDIα欠損細胞において免疫反応が増強し、より原虫数が少なくなることと一致している(図2B)。(B) Gbp2欠損細胞ではIrga6の動員率が低下していることから、Gbp2はトキソプラズマ寄生胞破壊タンパク質Irga6の働きを補助する機能があることが分かる。

図5 RabGDIαに存在する脂質結合ポケットが、Gbp2依存的免疫ブレーキ能に重要である
(A)コンピューター上でRabGDIαの構造を予測した結果、タンパク質に「穴」が開いていることが予測された(点線部)。(B)脂質結合部位に変異が入ったM132I型RabGDIαはGbp2と結合できなくなる(赤線部)。(C)野生型RabGDIαを発現させると(免疫反応にブレーキがかかるため)トキソプラズマ原虫数が増える(白棒 vs 黒棒)が、M132I型RabGDIαをさせても原虫数は変わらない(白棒 vs 赤棒)。すなわち、M132I型RabGDIαではブレーキ能が失われていることが分かる。

図6 RabGDIαのIFN-γ依存的抗トキソプラズマ免疫反応でのブレーキ機能とその抑制による免疫力強化
野生型細胞で起きている通常の免疫反応ではIFN-γ誘導性GTP分解酵素Gbp2にRabGDIαが脂質結合ポケットを介して結合しトキソプラズマ寄生胞への動員を妨げ、Gbp2の寄生胞破壊作用を阻害している(左上)。一方、RabGDIα欠損細胞ではGbp2がRabGDIαに妨げられずに、さらに多く寄生胞に動員されるようになるために、通常よりも強く免疫反応が起きる(右上)。その結果、野生型マウスが全数死亡する(左下)ような高力価のトキソプラズマ感染に対しても、抗トキソプラズマ免疫ブレーキ能が解除されたRabGDIα欠損マウスは生き延びることが可能になる(右下)。
参考URL
大阪大学微生物病研究所 感染病態分野HP
http://www.biken.osaka-u.ac.jp/lab/immpara/index.html
用語説明
- 宿主(しゅくしゅ)分子
宿主の細胞に由来するタンパク質。
- インターフェロン
病原体、あるいはガン細胞に対して体内防御的に働くタンパク質。アルファ、ベータ、ガンマなどがあり、それぞれ免疫反応に重要な働きをする。
- サイトカイン
免疫細胞から分泌されるタンパク質で、細胞間の情報伝達をするものの総称。
- 免疫沈降・質量分析法
可溶性の抗原と特定の抗体が反応して不溶化し沈殿する「免疫沈降反応」を利用して抗原(毒性分)を検出する実験法。生成物の質量(分子量)を測定する質量分析器を併用する。
- 好中球
免疫細胞の一種で、病原体の食作用を担う。トキソプラズマはマクロファージや好中球のような食細胞に寄生する。
