腸内で自然免疫細胞の一部が炎症性細胞の分化を誘導
クローン病など炎症性腸疾患の効果的な診断治療法開発に期待
リリース概要
大阪大学大学院医学系研究科の竹田潔教授(感染免疫医学講座 免疫制御学)と西村潤一助教、森正樹教授(外科学講座 消化器外科学)のグループは、ヒト大腸の粘膜に存在する自然免疫細胞 の一部が炎症性T細胞(Th17細胞) の分化を誘導する仕組みを明らかにしました。さらに当該グループは、我が国で約3万人が罹患し、特定疾患治療研究事業対象疾患にも指定されているクローン病 において、この自然免疫細胞が異常に活性化し、Th17細胞を過剰に誘導する能力を有していることを明らかにしました。この研究を進めることにより、クローン病をはじめとした炎症性腸疾患(IBD) の治療開発にも新たな可能性を与えると期待されます。

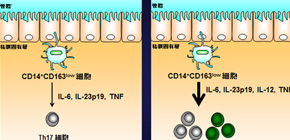
正常腸管におけるTh17細胞誘導性自然免疫細胞は炎症性サイトカインを放出することで、炎症性Th17細胞を誘導し、病原体等からの生体防御に寄与する。一方、クローン病におけるTh17細胞誘導性自然免疫細胞は過剰な炎症性サイトカインの放出によって炎症性Th17細胞を過剰に誘導するとともに、Th1細胞も誘導し、腸の粘膜が攻撃される。
研究の背景・本研究成果が社会に与える影響
近年、Th17細胞が炎症性腸疾患(IBD)に代表される自己免疫性疾患の病因と深く関連があることが明らかになってきました。マウスの腸管において、Th17細胞の誘導や炎症抑制に関わる自然免疫細胞は報告されていましたが、ヒトの腸管における自然免疫細胞の役割はよくわかっていませんでした。
本研究成果は、クローン病における炎症責任細胞の仕組みを明らかにしたもので、クローン病の治療法開発に新たな可能性を与えると期待されます。また、Th17細胞誘導性自然免疫細胞を制御することが可能となれば、IBDだけではなく、多くの自己免疫疾患の治療法開発に結びつくことが期待されます。
特記事項
本研究成果は、米国科学誌「Gastroenterology」のオンライン版で公開されました。
“Increased Th17-Inducing Activity of CD14+ CD163 low Myeloid Cells in Intestinal Lamina Propria of Patients with Crohn’s Disease”
なお、本研究は科学技術振興機構CRESTの支援を受けて行われました。
研究の詳細な説明
研究の背景
腸管に存在する免疫細胞は、細菌やウイルスといった異物を認識して攻撃・排除する一方で、腸内細菌や食べ物由来の抗原といった異物に対しては反応しない「免疫寛容 」の状態を保っており、絶妙なバランスで生体防御を担っています。腸管における免疫バランスの破綻は、日本で増加傾向にある炎症性腸疾患の原因となることが報告されています。
IBDの病因および発症機序は未解明な部分が多く、病態を根本的に改善する方法は確立されていません。IBDの特徴として炎症を導くT細胞が異常に増加していることが挙げられるため、今までのIBDの病因や発症機序の解明への取り組みはT細胞が主体である獲得免疫 系を中心としたものでした。しかし、近年、自然免疫細胞が獲得免疫系の活性化に深く関わっていることが明らかとなり、IBDの過剰炎症における自然免疫細胞の役割に注目が集まっています。
これまで、腸内での免疫寛容状態の維持や、過剰炎症状態に重要な役割を果たす自然免疫細胞の研究はマウスの実験において報告されてきましたが、ヒトの腸管に存在する自然免疫細胞についての報告はほとんどされていません。
そこで本研究グループは、ヒトの腸管において、炎症を引き起こす自然免疫細胞が存在するのかを調べ、さらにクローン病腸管の自然免疫細胞の役割を解析しました。
研究の内容
研究グループは、炎症性Th17細胞を分化誘導する自然免疫細胞を探すために、ヒトの大腸粘膜からT細胞の分化誘導に関係する細胞を回収したところ、その表面のタンパク質の発現により4種類の細胞集団が存在していることを発見しました( 図1 )。
これらの細胞集団を調べたところ、この中の一種類(CD14+ CD163low細胞)が、病原体を感知して自然免疫を作動させるToll 様受容体(TLR2、TLR4、TLR5)を発現しており、炎症性サイトカインIL-6、IL-23p19、TNFを産生するグループであることが確認され、さらにTh17細胞の分化を誘導することが明らかになりました。そこで、この細胞種(CD14+ CD163low細胞)をTh17細胞誘導性自然免疫細胞と名付けました。
またTh17細胞誘導性自然免疫細胞はマクロファージ様の形態をしており、遺伝子発現パターンからマクロファージと樹状細胞の両方の特徴を持っている細胞であることが明らかになりました。
次に、Th17細胞誘導性自然免疫細胞のクローン病腸管における機能解析を行いました。正常腸管と比較して、クローン病腸管のTh17細胞誘導性自然免疫細胞は炎症性サイトカインIL-6、IL-23p19、TNF、IL-12p35の発現が顕著に増加しており、極めて高いTh17細胞の分化誘導能を示されました( 図2 )。また正常腸管のTh17細胞誘導性自然免疫細胞からはIL-12p35の発現はほとんど見られませんが、クローン病腸管のTh17細胞誘導性自然免疫細胞からはIL-12p35も発現するようになり、結果としてTh1細胞をも誘導されることがわかりました。
本研究の結果より、Th17細胞誘導性自然免疫細胞がTh17細胞免疫を介し、クローン病の発症および増悪に重要な役割を果たすことが推測されました。
今後の展開
今後、Th17細胞誘導性自然免疫細胞の簡便な同定法や制御法が開発されることにより、クローン病の効果的な診断および治療につながることが期待されます。
近年、腸内細菌叢 の変化に伴う腸管免疫寛容の破綻が、IBDだけでなく、関節リウマチや多発性硬化症などの自己免疫疾患の発症に深く関与することが報告されています。いずれも、欧米化された食生活をはじめとするライフスタイルの変化に伴い日本で増加してきている難病です。樹状細胞やマクロファージといった自然免疫細胞は腸管の恒常性維持に重要な役割を果たすことが知られており、自然免疫細胞を制御することで腸管恒常性を維持し、さまざまな自己免疫疾患を治療あるいは予防できるのではないかと考えられます。実際の臨床現場で用いる事が出来るような方法でTh17細胞誘導性自然免疫細胞を制御することが可能となれば、IBDだけではなく、多くの自己免疫疾患の治療法開発に結びつくことが期待されます。
参考図
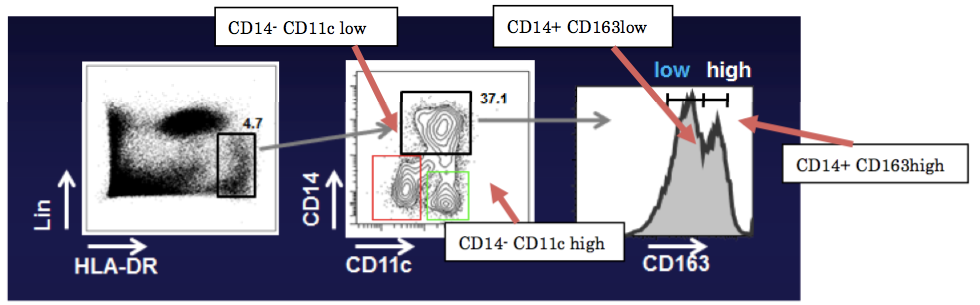
図1 大腸粘膜固有層に存在する自然免疫細胞の同定
ヒト大腸より回収した腸管粘膜固有層細胞をHLA-DR、Lin(CD3、CD19、CD20、CD56)、CD14、CD11c、CD163で染色すると、CD14+ CD163low、CD14+ CD163high、CD14- CD11c high、CD14- CD11c lowの4集団に細分化できた。

図2 正常およびクローン病におけるCD14+ CD163low細胞のTh17細胞免疫能
CD14+ CD163low細胞をナイーブT細胞と共培養し、Th17細胞への分化誘導能を評価した。正常腸管(NC)と比較して、クローン病腸管の炎症部(CDi)だけでなく非炎症部(CDn)でもTh17細胞の誘導能が増強されていることが確認された。また、Th17細胞のみでなく、Th1細胞も有意に誘導されていることが分かった。
参考URL
大阪大学大学院医学系研究科 感染免疫医学講座 免疫制御学
http://www.med.osaka-u.ac.jp/pub/ongene/index.html
大阪大学 大学院医学系研究科 外科学講座 消化器外科学
http://www.med.osaka-u.ac.jp/pub/gesurg/index.html
用語説明
- 自然免疫細胞
体内に病原体が侵入した際に、最初の生体防御反応として機能する免疫細胞。異物の構成成分を認識することで活性化し、病原体を貪食する。マクロファージや樹状細胞などが含まれる。
- Th17細胞
T細胞の一種で、通常感染症の防御に働く。しかし、数が過剰になったり、暴走すると炎症を誘導するようになる。
- クローン病
口腔から肛門までの全消化管(主に小腸と大腸)に非連続性の慢性肉芽腫性炎症を生じる原因不明の炎症性疾患。潰瘍性大腸炎と同様に厚生労働省より特定疾患治療研究対象疾患に指定されている。
- 炎症性腸疾患(IBD)
免疫細胞により腸の粘膜が攻撃され炎症を起こす自己免疫疾患で、発症の原因は分かっていない。潰瘍性大腸炎やクローン病などがある。
- 免疫寛容
病原性のない微生物や自己の細胞に対して免疫細胞が反応を示さない状態。
- 獲得免疫
獲得免疫細胞:
自然免疫細胞が貪食し、提示した病原体の特徴的分子に対してT細胞が抗体(B細胞)を作ることで病原体に対抗する獲得免疫反応を担当する細胞で、T細胞とB細胞が主体となる。
- 腸内細菌叢
腸内には100種類以上、100兆個以上の腸内細菌が生息しており、宿主であるヒトや動物の栄養分の一部を利用しながら、他の腸内細菌とバランスを取って一種の生態系を形成しており、この生態系を腸内細菌叢(腸内フローラ)と呼ぶ。
