心不全ワクチンの開発に期待
IGFBP7による心筋細胞代謝抑制メカニズムを解明
研究成果のポイント
ワクチンで心不全を治療
概要
東京大学大学院医学系研究科 先端循環器医科学講座の加藤愛巳特任助教、野村征太郎特任准教授、小室一成特任教授、先端科学技術研究センター ゲノムサイエンス&メディシン分野の油谷浩幸シニアリサーチフェロー(東京大学名誉教授)らの研究グループは、心不全モデルマウスを用いて、世界で初めて心不全ワクチンの開発に成功しました。本研究では、心臓血管内皮細胞が分泌するIGFBP7というタンパクが心筋細胞のミトコンドリア代謝を抑制し、心不全を引き起こしていることを明らかにしました。さらに、IGFBP7に対するワクチンを大阪大学大学院医学系研究科健康発達医学寄附講座の中神啓徳寄附講座教授らと共同開発しマウスに投与したところ、心不全モデルマウスの心臓の機能が改善しました。これにより、ワクチンで心不全増悪因子の働きを抑制することで、心不全を治療するというこれまでにない新しい心不全治療法の可能性が示されました。本研究成果は、日本時間7月12日に米国科学誌「Circulation」に掲載されました。
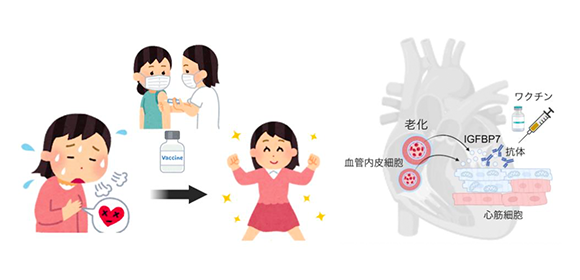
図1. 老化した心臓血管内皮細胞からIGFBP7が分泌され心筋細胞の酸化的リン酸化を抑制
加齢や心疾患で老化した心臓血管内皮細胞からIGFBP7が分泌され、それによって心筋細胞におけるインスリンシグナルが阻害されることで、心筋細胞のミトコンドリア代謝に異常が生じ、心不全を引き起こす。
研究の背景
心不全は、多因子疾患であり予後不良の疾患です。現時点では心臓移植以外に根治的治療法は存在しません。発症すると労作時呼吸困難等から始まり、進行すると安静時呼吸困難、起座呼吸となり著しく生活の質が低下します。心臓の機能が低下すると、心臓内に血栓が生じるリスクや、致死的な不整脈の発生リスクが生じ、非常に危険な状態となります。心不全の原因は未だ不明で、根本的な治療法開発も進んでいないのが現状です。唯一の治療法である心臓移植の待機期間は、日本では2~5年と長く、仮に移植を行えたとしても、生涯にわたる免疫抑制薬の服用、感染予防の徹底など、患者さんは大きな負担を強いられます。心不全に対する原因究明と新たな治療法開発は喫緊の課題となっています。さらに、心不全は世界的にも主要な死因の一つであり、より広範囲での治療を可能にする必要があるため、安価で簡便な治療法の開発が求められています。
本研究グループは、心不全の原因物質として、心臓血管内皮細胞が分泌するIGFBP7を同定しました。そして、それに対するワクチンを開発し、心不全への効果を確認しました。
研究の内容
心不全の病態を解明するために、心不全モデルマウスを用いて、心筋細胞と非心筋細胞の同時single cell RNA-seq(単一細胞遺伝子発現解析)を行いました。その結果、心不全状態の内皮細胞において、IGFBP7遺伝子を高発現している細胞集団を同定しました。また、この細胞集団は老化細胞集団であることも示しました。さらに、同一個体から取得した心筋細胞のsingle cell RNA-seqデータ解析、メタボローム解析、iPS心筋細胞の解析、といった種々の結果によって、内皮細胞から分泌されたIGFBP7が心筋細胞の酸化的リン酸化を抑制することで、ミトコンドリアが機能不全へと陥ることがわかりました。このことから、心不全の病態として、老化した内皮細胞から分泌されたIGFBP7が細胞間相互作用で心筋細胞のミトコンドリア機能を抑制することで心不全を誘発するという、新たな知見を得ることができました。さらに、大阪大学大学院医学系研究科健康発達医学寄附講座の中神啓徳寄附講座教授らとIGFBP7に対するワクチンを共同開発し、ワクチン投与によって、心不全モデルマウスの心機能を改善させることに成功しました。
今後の展望
本研究によって、世界で初めて、ワクチンによる心不全治療の可能性が示されました。ワクチンは、安価で製造でき、接種も容易なうえ、副作用が比較的少ないことが知られています。心不全は世界的に主要な死因の一つであり、ワクチンのような汎用性の高い治療法があれば、より多くの心不全患者に治療を提供することができます。またワクチンは、心不全の発症リスクが高い患者さんに対して早期に接種することで、心不全を予防する手段にもなり得ます。今後、さらにワクチン開発を進めることで、世界中の多くの心不全患者さんの役に立つことが期待されます。
特記事項
【論文情報】
雑誌名: Circulation
題 名: Vaccine therapy for heart failure targeting an inflammatory cytokine Igfbp7
著者名: Manami Katoh, Seitaro Nomura*, Shintaro Yamada, Masamichi Ito, Hiroki Hayashi, Mikako Katagiri, Tuolisi Heryed, Takayuki Fujiwara, Norifumi Takeda, Miyuki Nishida, Maki Sugaya, Miki Kato, Tsuyoshi Osawa, Hiroyuki Abe, Yoshitaka Sakurai, Toshiyuki Ko, Kanna Fujita, Bo Zhang, Satoshi Hatsuse, Takanobu Yamada, Shunsuke Inoue, Zhehao Dai, Masayuki Kubota, Kousuke Sawami, Minoru Ono, Hiroyuki Morita, Yoshiaki Kubota, Seiya Mizuno, Satoru Takahashi, Makoto Nakanishi, Tetsuo Ushiku, Hironori Nakagami, Hiroyuki Aburatani*, Issei Komuro*
(*責任著者)
DOI:10.1161/CIRCULATIONAHA.123.064719
本研究は、日本医療研究開発機構(AMED)ゲノム研究を創薬等出口に繋げる研究開発プログラム「心不全シングルセルゲノミクス創薬」(代表:小室一成)、ゲノム医療実現バイオバンク利活用プログラム(ゲノム医療実現推進プラットフォーム・先端ゲノム研究開発)「マルチオミックス連関による循環器疾患における次世代型精密医療の実現」(代表:小室一成)、難治性疾患実用化研究事業「オールジャパン拡張型心筋症ゲノムコホート研究によるゲノム医療の発展」(代表:野村征太郎)、「難治性心血管疾患におけるマルチオミックス解析による病態解明と精密医療」(代表:小室一成)、「シングルセル分子病理解析による心臓サルコイドーシスのバイオマーカー同定と治療標的探索」(代表:小室一成)、循環器疾患・糖尿病等生活習慣病対策実用化研究事業「空間的シングルセル解析によるHFpEFの病態解明」(代表:小室一成)、「DNA損傷応答・核形態の機械学習による心不全の予後・治療応答予測モデルの構築」(代表:小室一成)、革新的先端研究開発支援事業「心筋メカノバイオロジー機構の解明による心不全治療法の開発」(代表:小室一成)、科研費・基盤研究S「非分裂細胞である心筋細胞のDNA損傷と老化による心不全発症機序の解明と応用(課題番号:21H05045)」(代表:小室一成)、科研費・基盤研究A「複合的アプローチによる心臓システム構造の統合的理解とその制御(課題番号:22H00471)」(代表:野村征太郎)、科研費・若手研究「RNA motionによる細胞間相互作用の時空間的理解への挑戦(課題番号:22K16131)」(代表:加藤愛巳)、科研費・基盤研究C「心不全病態制御因子の網羅的検索(課題番号:24K11211)」(代表:加藤愛巳)、科学技術振興機構(JST)創発的研究支援事業「心筋細胞の可塑性に着目した心不全の層別化と治療法の開発」(代表:野村征太郎)、UTEC-UTokyo FSI Research Grant Program(代表:野村征太郎)等の支援により行われました。
用語説明
- 心臓血管内皮細胞
血管は内膜・中膜・外膜の3層で構成され、血液と接しているいちばん内側は内皮細胞で覆われています。この内皮細胞の機能が低下すると、心不全などさまざまな疾患を引き起こすことが知られています。
- IGFBP7
分泌タンパクの一種。細胞老化関連分泌形質、SASP(Senescence Associated Secretory Phenotype)としても知られています。インスリンレセプターや、インスリンと結合し、細胞内にインスリンのシグナルが伝わるのを阻害することが知られています。
- iPS心筋細胞
iPS細胞(人工多能性幹細胞)から作られた心筋細胞のことを指します。iPS細胞は皮膚や血液などの体細胞から作られ、その後、心筋細胞を含むさまざまな細胞種に分化する能力を持っています。iPS細胞を特定の条件で培養することで、iPS心筋細胞に分化させることができます。iPS心筋細胞は、病気のモデル作成、薬剤のスクリーニングなどに用いられています。
- 酸化的リン酸化
主にミトコンドリア内で行われるこのプロセスは、呼吸鎖と呼ばれる一連の反応を通じて行われ、最終的にATP(アデノシン三リン酸)という心筋細胞の収縮に必要なエネルギー分子を生成します。
