ヒト大腸がん組織に棲む記憶T細胞の機構を解明
精密な診断や治療法の開発に期待
研究成果のポイント
- シングルセル(単一細胞)シーケンス情報でヒト大腸がん組織に棲む記憶T細胞(Trm)を解析
- 解析の結果、ヒト大腸がんTrmが患者の予後と相関することを確認
- さらに、Trmはハブとなる転写因子ZNF683を介して患者予後に関わることを解明
- ヒト大腸がんTrmのZNF683が、大腸がんの精密な診断と治療法の開発に繋がる可能性に期待
概要
大阪大学大学院医学系研究科の石井秀始 特任教授(常勤)、原知明 特任助教(常勤)(疾患データサイエンス学)と江口英利 教授、土岐祐一郎 教授(消化器外科学)らの研究グループは、現在国内外で利用可能な大腸がん組織に浸潤している免疫担当細胞のシングルセル解析を行うことによって、がん組織に入り込んで免疫記憶や抗がん作用に関わる機能を担当する「組織レジデントT細胞(Trm)」の遺伝子発現機構を明らかにしました。
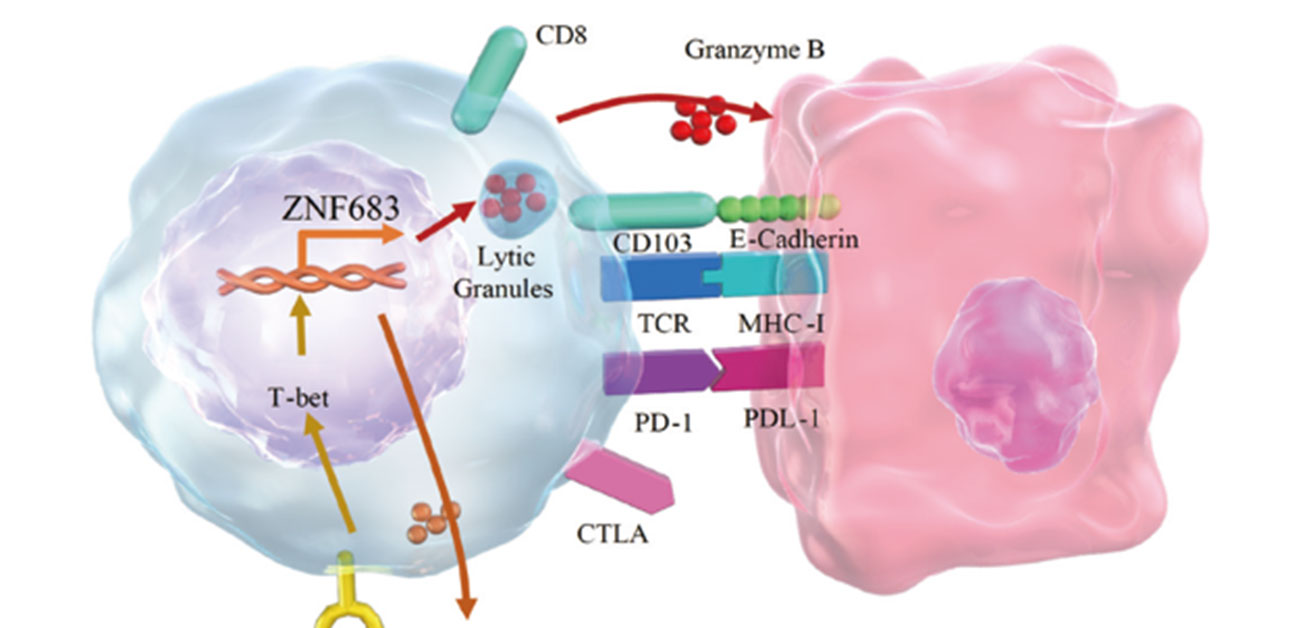
解析の結果、ヒト大腸がんTrmが患者の予後と相関すること、さらにTrmは、ハブとなる転写因子ZNF683を介して患者予後に関わっていることを解明しました。
この研究の成果は、精密な診断と治療法の開発に繋がるだけでなく、がんの発生と進展における免疫学的な関与の重要性の解明に向けて、研究基盤の構築に寄与することが期待されます。
本研究成果は、2023年3月3日(金)(日本時間)に英国科学雑誌「British Journal of Cancer」(オンライン)に掲載されました。
図1. 大腸がんに浸潤した免疫担当細胞のシングル細胞解析により、がんに関わるTrmの遺伝子発現機構を明らかにすることができた。
研究の背景
大腸がんは世界的にも最も発生頻度が高いがんの1つです。診断技術の向上と治療法の進歩によって予後は改善しつつありますが、依然としてがん死亡者数の首位を占めており、またステージが進んだ段階では予後が良くない状態にあります。
本研究では、患者毎に異なる可能性がある免疫学的な応答機構として、記憶T細胞Trmに着目した研究を行いました。がんの組織には免疫担当細胞を含めてさまざまな細胞が入り込んでおり、相互に作用をもたらしています。本研究で実施したシングルセル解析はたいへん有力な研究手法であり、がん微小環境を俯瞰的に捉えるとともに、その内部でのTrmのような特定の細胞に焦点を当てた掘り下げが可能となります。
研究の内容
研究グループは、現在国内外で利用可能な全17,257個の免疫担当細胞のシングル細胞セル解析により、大腸がんの予後が比較的良い患者と、比較的悪い患者のTrmの特徴を調べました。その結果、転写因子ZNF683が、がん抗原に対するT細胞受容体(TCR)の応答の下流でハブとなる役割を担って、Trmが抗腫瘍免疫サイトカインであるインターフェロンの発現に重要な役割を担っていることを明らかにしました。
これまでの国内外の研究において、発がんの過程で、異常な細胞の免疫学的な「排除段階」、免疫と拮抗する「平衡段階」、免疫学的な監視を逸脱する「逃避段階」があることが示されてきました。発がんの段階で免疫学的な記憶がいつ形成され、がんの発生と進展にどのように関わっているのかはよくわかっていませんが、本研究では、Trmががん組織の免疫的な記憶に関わっていることが示され、その鍵となる分子機構の一部を明らかにすることができました。
さらに、患者の予後と関わるTrmの分子機構として転写因子ZNF683のカスケードを明らかにしました。
この研究成果は、がんの精密な診断と治療法の開発に繋がるだけでなく、がんの発生と進展における免疫学的な関与の重要性解明に向けた研究基盤構築に寄与しました。
本研究成果が社会に与える影響(本研究成果の意義)
本研究成果により、大腸がんに対する画期的な診断、革新的な治療法の開発に貢献できることが期待されます。
特記事項
本研究成果は、2023年3月3日(金)(日本時間)に英国科学雑誌「British Journal of Cancer」(オンライン)に掲載されました。
タイトル:“Cancer-specific tissue-resident memory T-cells express ZNF683 in colorectal cancer”
著者名:Masatoshi Kitakaze1, Mamoru Uemura1, Tomoaki Hara2, Ryota Chijimatsu2, Daisuke Motooka3, Toshiro Hirai3, Masamitsu Konno2,#, Daisuke Okuzaki3, Yuki Sekido1, Tsuyoshi Hata1, Takayuki Ogino1, Hidekazu Takahashi1, Norikatsu Miyoshi1, Ken Ofusa2,4, Tsunekazu Mizushima1, Hidetoshi Eguchi1, Yuichiro Doki1, Hideshi Ishii2,*
1. Department of Gastroenterological Surgery, Osaka University Graduate School of Medicine, Suita, Osaka 565-0871, Japan.
2. Department of Medical Data Science, Center of Medical Innovation and Translational Research, Osaka University Graduate School of Medicine, Suita, Osaka 565-0871, Japan.
3. Genome Information Research Center, Research Institute for Microbial Diseases, Osaka University, Suita, Osaka 565-0871, Japan.
4. Prophoenix Division, Food and Life-Science Laboratory, Idea Consultants, Inc., Osaka-city, Osaka 559-8519, Japan.
#Present address: National Institute of Advanced Industrial Science and Technology, Koto-ku, Tokyo 135-0064, Japan.
DOI:https://doi.org/10.1038/s41416-023-02202-4
なお、本研究は、大阪大学大学院医学系研究科 石井秀始 特任教授(常勤)、原知明 特任助教(常勤)(疾患データサイエンス学)との江口英利 教授、土岐祐一郎 教授(消化器外科学)らの研究費として、科研費基盤研究(17cm0106414h0002; JP21lm0203007; 18KK0251; 19K22658; 20H00541; 21K19526; 22H03146; 22K19559)、先進ゲノム解析研究推進プラッフォトーム(16H06279 (PAGS))等の一環として行われました。
参考URL
大阪大学 大学院医学系研究科 共同研究講座 疾患データサイエンス学 URL
https://www.med.osaka-u.ac.jp/pub/mds/
用語説明
- 大腸がん
世界的にも最も発生頻度が高いがんの1つとしてあげられる。
- シングルセル解析
単一細胞レベルでRNAシークエンスを可能とする画期的な技術。
- がん微小環境
がん上皮細胞だけでなく、線維がん細胞、免疫細胞も含まれる。がんの悪性化にとって有利なシステムを構築していると考えられ、その究明が喫緊の課題となっている。
