食道がん抗がん剤耐性のブレークスルーに!
APR-246による変異p53遺伝子の機能回復がカギ
研究成果のポイント
概要
阪大学大学院医学系研究科の小林照之招へい教員、牧野知紀助教、土岐祐一郎教授(消化器外科学)、森井英一教授(病態病理学)らの研究グループは、食道がんに非常に高頻度に認めるp53変異遺伝子に着目し、変異p53機能回復薬である「APR-246(別名PRIMA-1MET)」の投与により食道がんの化学療法の感受性を高める新規治療法を開発しました。
食道(扁平上皮)がんは悪性度が高く予後不良であり、進行例の治療成績の改善には手術、化学療法、放射線療法といった集学的治療が必要になります。しかし、術前化学療法など治療へ抵抗性(耐性)を示すケースは極めて予後不良です。食道がんは他がんと比較しても非常に高率でp53遺伝子変異を伴っており、その大半はミスセンス変異といわれるものです。p53遺伝子はがん抑制遺伝子として知られており、細胞ががん化するとアポトーシスと呼ばれる細胞死を引き起こすことでがん化を防ぎます。このp53の機能を失うような遺伝子変異はがんの悪性度はもとより化学療法や放射線治療の耐性に寄与するとされます。
今回、牧野知紀助教らの研究グループは、変異p53 を発現する細胞にアポトーシスを誘導する化合物である、変異p53機能回復薬(APR-246)に着目しました。その結果、p53ミスセンス変異遺伝子を伴う食道がんへのAPR-246投与により著明な抗腫瘍効果が得られ、さらに、APR-246と化学療法とを併用することで相乗または相加効果を示すことを明らかにしました。これは、APR-246投与によりp53ミスセンス変異腫瘍に選択的に活性酸素種が生成され、p53のファミリーメンバーでp53と同じくアポトーシスを誘導する機能を持つp73を介してアポトーシス誘導が増強されるためであることがわかりました(図1)。
本研究成果により、食道がんにおけるAPR-246の作用機序を明らかにし、p53ミスセンス変異食道がんに対してAPR-246投与することにより化学療法感受性が向上する可能性が示唆されました。今後、難治性である食道がんのオーダーメイド治療の確立および治療成績の向上につながることが大いに期待されます。本研究成果は、英国科学誌「British Journal of Cancer」に、2021年10月1日(金)に公開されました。
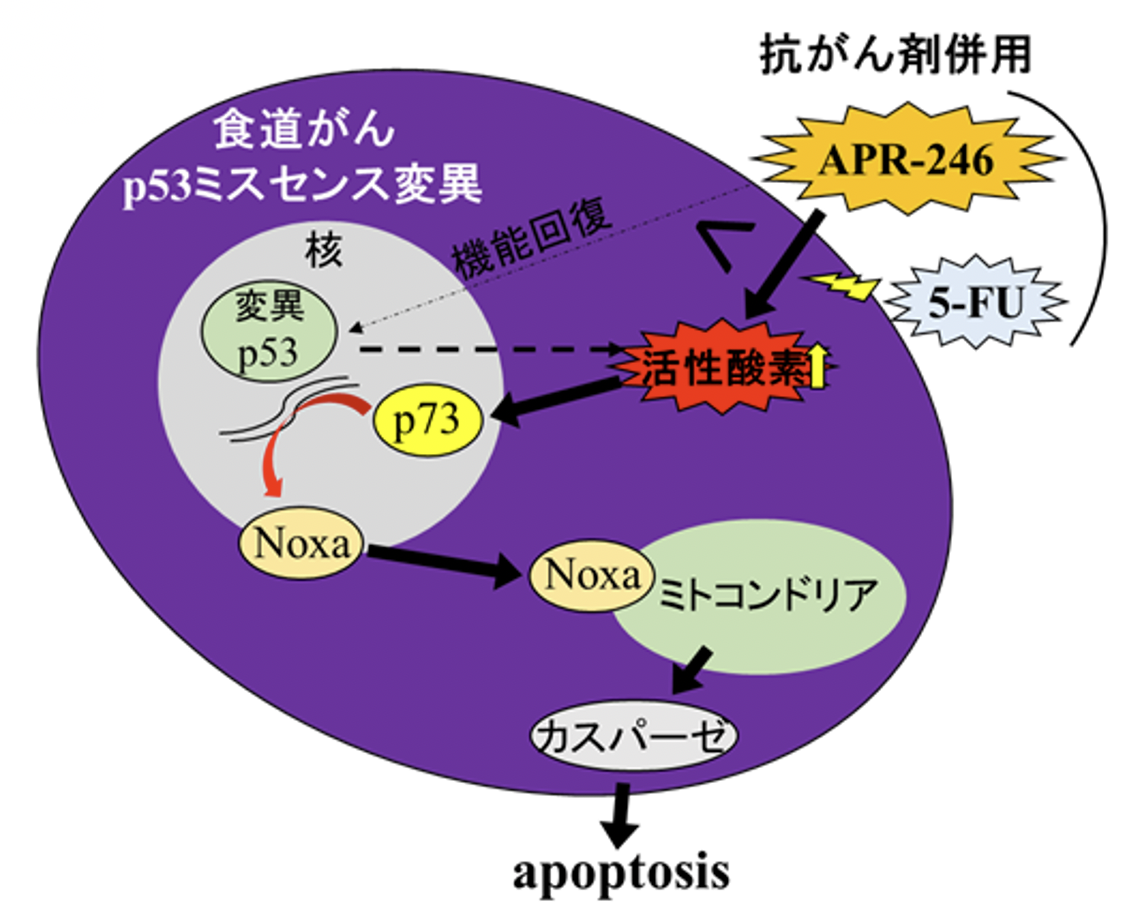
図1. 食道扁平上皮癌p53ミスセンス変異におけるAPR-246の作用機序
研究の背景
食道扁平上皮がんは、さまざまながん種の中でもがん抑制遺伝子p53の遺伝子変異率が9割と極めて高いことが知られており、p53遺伝子変異があると、がんの悪性度に関与したり、臨床上も化学療法や放射線療法に対して抵抗性(耐性)を示すことが分かっています(Makino T et al. Ann Surg Oncol 2010, Yamasaki M et al. Ann Surg Oncol 2010)。一方で、治療への抵抗性を示すケースは予後が極めて不良であるため、治療成績・予後の改善のためには変異p53遺伝子(またはそのファミリー遺伝子)の機能を回復させ治療抵抗性を克服することが重要だと考えました。牧野知紀助教らの研究グループは先行研究として、食道がんにおいて変異p53機能回復薬PRIMA-1(p53 re-activation and induction of massive apoptosis)が強いアポトーシス誘導による抗腫瘍効果を示すことを見出しました(Furukawa H, Makino T, et al. Cancer Sci. 2018)が、その作用機序の詳細は不明でした。今回、同じ変異p53機能回復薬PRIMA-1でもより安定化した分子構造をもち、ヒトへの投与の安全性も実証されているAPR-246(メチル化PRIMA-1)に着目し、そのより詳細な作用機序の解明と食道がんの抗がん剤との併用など新規治療法として応用できないか検証しました。
本研究の成果
牧野知紀助教らの研究グループは、食道扁平上皮がん細胞株を用いた実験で、細胞株に対するAPR-246単剤投与による細胞生存率はp53ミスセンス変異株で低く、それ以外の株(野生株、p53の機能を欠失するような変異であるフレームシフト・ナンセンス変異株)では概ね高値であることを明らかにしました(図2A)。p53ミスセンス変異株においては、APR-246投与によりp73およびその下流のNoxa発現、ROS活性の上昇を認め、アポトーシス (cleaved PARP)が強く誘導されました。これらの現象はROS阻害剤であるN-アセチルシステインをAPR-246と併用投与することでキャンセルされました(図2B.C)。さらに、Noxa遺伝子機能を抑制するノックダウン下ではAPR-246投与によるアポトーシス誘導(cleaved PARP発現上昇)は減弱し、またp73遺伝子のノックダウン下ではAPR-246投与によるNoxa・cleaved PARP上昇がそれぞれ抑制され、アポトーシス誘導が減弱しました(図2D)。一方で、p53野生株ではNoxa・p73のノックダウン下でもこれらの現象は認めなかったことから、食道扁平上皮癌に対するAPR-246の作用機序としてp53ミスセンス変異株に選択的なROS活性の上昇およびp73・Noxa発現上昇によるアポトーシス誘導が重要であると考えられました。
また、化学療法との併用に関しては、とくにp53ミスセンス変異株において併用効果を認めましたが、とくに5-FUとの併用で顕著でした。これは、APR-246と5-FUとの併用投与でAPR-246によるROS活性の誘導がさらに増強し、p73-Noxa経路を介したアポトーシス誘導が一段と高まったことが寄与したものと考えられました(図2B.C.3D )。
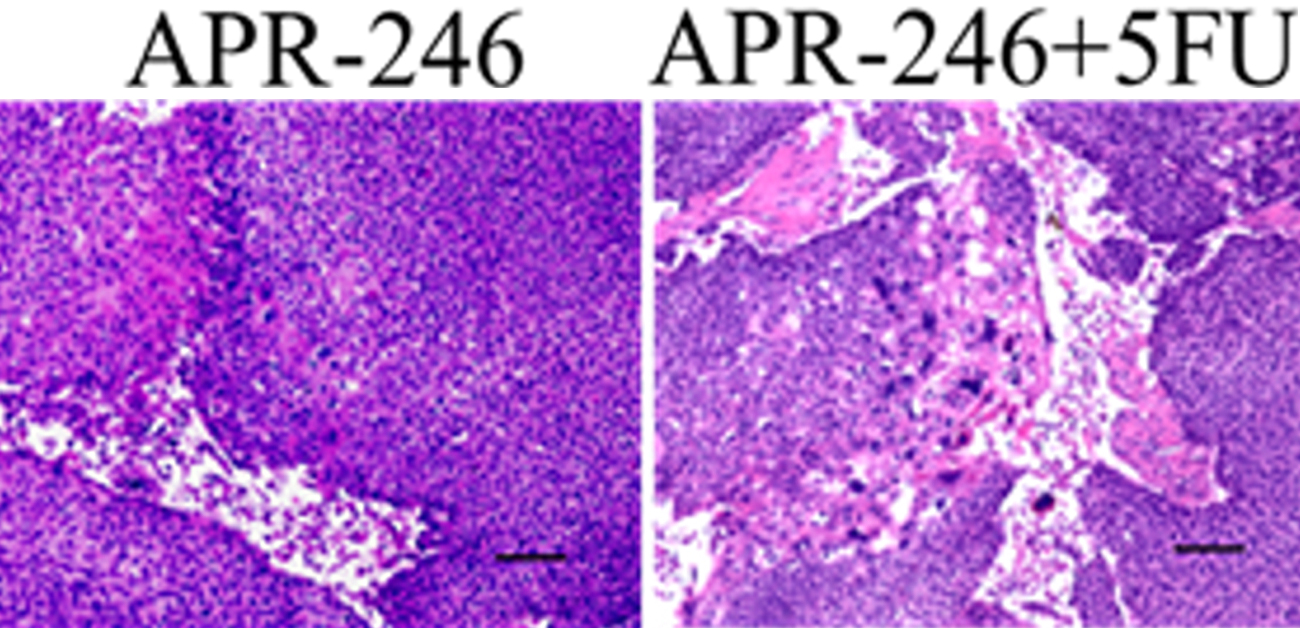
マウスを用いた動物実験においても、p53ミスセンス変異株(TE8)の皮下腫瘍モデルでのみAPR-246+5-FUの併用効果がみられ(図3.A)、ROS活性の誘導およびp73・Noxa発現上昇によるアポトーシスの増強を認めました。さらにPDXモデル (exon5,7のミスセンス変異を伴う食道扁平上皮癌患者由来腫瘍)においても同様にAPR-246+5-FUの併用効果を認め(図3.B)、ROS活性の増強、p73/Noxa発現上昇およびアポトーシス誘導が関与していることが分かりました。
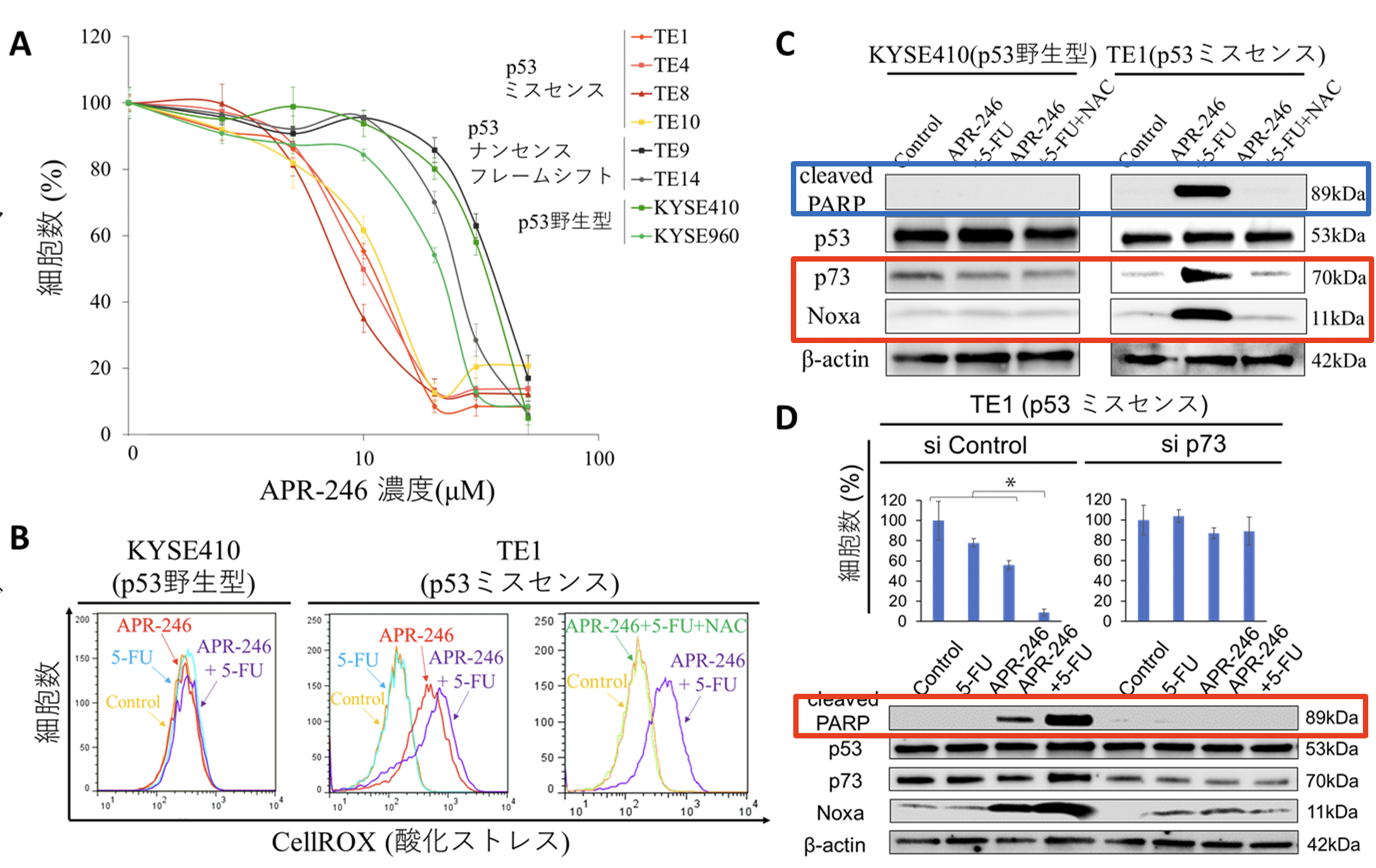
図2. A.細胞生存率アッセイにて、APR-246で48時間治療した後の食道がん細胞株のAPR-246用量反応曲線。
B.食道がん細胞株(KYSE410、TE1)をPBS、APR-246、5-FU、APR-246と5-FUとの併用、APR-246と5-FUとN-アセチルシステイン(NAC)の併用で治療した際の酸化ストレス。右にシフトしているほど、酸化ストレスが強いことを示す。
C.食道がん細胞株(KYSE410、TE1)をPBS、APR-246と5-FUとの併用、APR-246と5-FUとN-アセチルシステイン(NAC)の併用で治療した際のWestern Blotでのシグナル変化。バンドの色が濃いほど、タンパク質の発現量が高い。
D.TE1において、p73をノックダウンした際の、PBS、APR-246、5-FU、APR-246と5-FUとの併用治療時の生存細胞率(%)とWestern Blotでのシグナル変化。
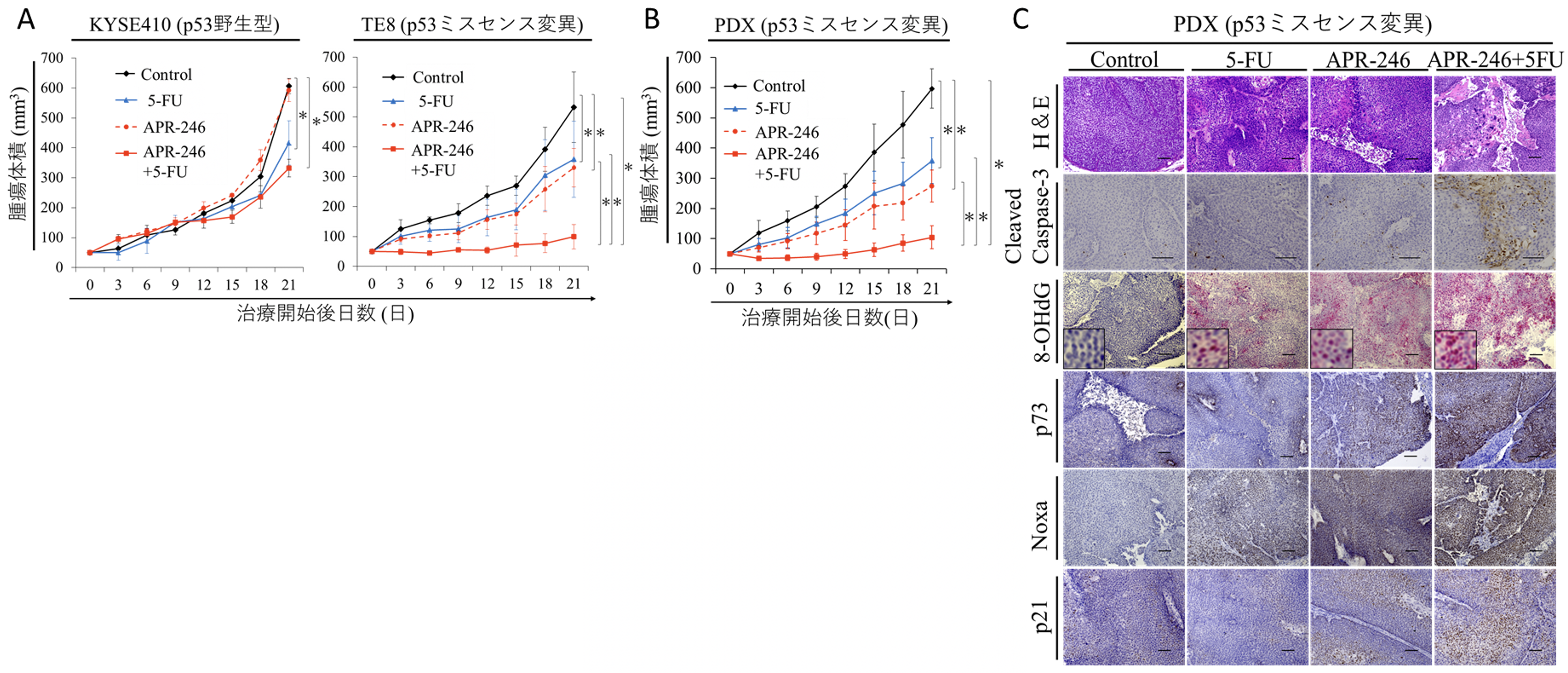
図3. A.皮下腫瘍モデル(KYSE410、TE8)を用いた、APR-246と抗がん剤(5-FU)の併用療法における腫瘍体積の変化。*<0.05
B. PDXモデル(p53ミスセンス変異)を用いた、APR-246と抗がん剤(5-FU)の併用療法における腫瘍体積の変化。
C.PDXモデル(p53ミスセンス変異)を用いた、APR-246と抗がん剤(5-FU)の併用療法におけるシグナルの変化(免疫染色)。8-OHdGは酸化ストレスを反映。
本研究成果が社会に与える影響(本研究成果の意義)
本研究での知見により、極めて予後不良である食道がんにおいてAPR-246投与により化学療法耐性を克服できる可能性を見出しました。これにより、治療前に食道がん組織におけるp53遺伝子変異のステータスを評価し、それに応じた治療法を選択するといった「オーダーメイド治療」の確立に大きく貢献し、最終的には難治性である食道がん全体の飛躍的な治療効果および予後の改善につながるものと期待されます。
特記事項
本研究成果は、2021年10月1日(金)に英国科学誌「British Journal of Cacer」に掲載されました。
【タイトル】 “APR-246 Induces Apoptosis and Enhances Chemo-Sensitivity via Activation of ROS and TAp73-Noxa Signal in Oesophageal Squamous Cell Cancer with TP53 Missense Mutation ”
【著者名】 Teruyuki Kobayashi1, Tomoki Makino1†, Kotaro Yamashita1, Koji Tanaka1, Takuro Saito1, Tsuyoshi Takahashi1, Yukinori Kurokawa1, Makoto Yamasaki1, Kiyokazu Nakajima1, Eiichi Morii2, Hidetoshi Eguchi1, Yuichiro Doki1.
【所属】
1.大阪大学 大学院医学系研究科 消化器外科学
2.大阪大学 大学院医学系研究科 病態病理学
†責任著者
【DOI】 10.1038/s41416-021-01561-0
用語説明
- APR-246
変異p53 を発現する細胞にアポトーシスを誘導する化合物ライブラリーのスクリーニングによって見つかった化合物(Bykovet VJ et al, Nat Med 2002)であるPRIMA-1(p53 re-activation and induction of massive apoptosis)のメチル化化合物。APR-246であるEprenetapoptはAprea Therapeutics社の治験薬。
- ミスセンス変異
コドン内の塩基の置換によって異なったアミノ酸残基が合成中のポリペプチド鎖に入り、異常蛋白質が産生されること。点突然変異の一種である。
- 術前化学療法
手術の前に抗がん剤治療を行うこと。腫瘍を小さくしてかつ微小転移を撲滅することでより長期の生存が得られることが分かっており現在進行食道がんにおいての標準治療となっている。
- PDXモデル
Patient-derived xenograftsのことで、免疫不全マウス(マウスの免疫力を強く抑え、拒絶反応が起きにくいマウス)に患者さんの腫瘍組織をそのまま移植する手法。
