30億から特定の遺伝子を探しだす不思議―光に反応する転写因子の1分子構造動態を世界初計測
遺伝子発現を制御する分子の機能メカニズムの解明へ
研究成果のポイント
概要
大阪大学大学院基礎工学研究科大学院生の辻明宏さん(博士後期課程)、山下隼人助教、阿部真之教授、大阪大学大学院理学研究科の久冨修准教授は、高速原子間力顕微鏡(高速AFM)を用いて、遺伝子発現を制御する転写因子と呼ばれるタンパク質の詳細な1分子構造動態を計測することに世界で初めて成功しました。
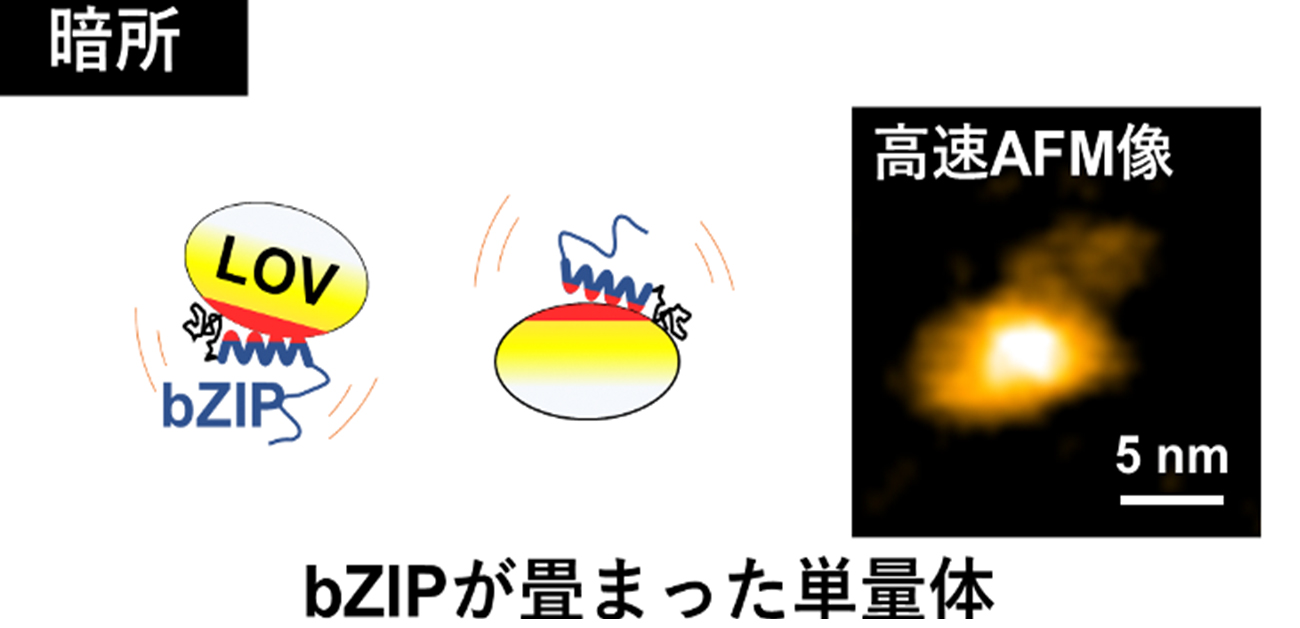
転写因子は遺伝子発現の制御を通じて細胞の様々な機能を担う、すべての生物にとって必要不可欠なタンパク質ですが、膨大な遺伝情報を含むDNAの中から特定の遺伝子をどのように探し出して制するかは生命の大きな謎の一つでした。様々な研究から多くの転写因子が二量体を形成していることが分かってきており、この二量体形成が謎を解く重要な鍵として注目されていましたが、その形成の仕組みはこれまで良く分かっていませんでした。今回、上記研究グループは、藻類の光依存的な分枝に関わる転写因子を改変したPhotozipper(略してPZ)というタンパク質分子を、高速AFMと呼ばれる新しい顕微鏡を利用して観察しました。その結果、この分子が光依存的に構造を変える様子やそれらが結合して二量体を形成する様子が世界で初めて明らかになりました(図1)。これは転写因子が遺伝子発現を制御する仕組みを解明する上で非常に重要な成果です。転写因子はがん細胞の増殖や免疫応答など多くの疾患にも関わっていることから、今後は医学的な応用研究にも繋がると期待されます。
本研究成果は、国際学術誌「Scientific Reports」に、2022年8月8日(月)18時(日本時間)に公開されました。
図1. 高速AFMで捉えられた転写因子Photozipper(PZ)分子の構造。PZ分子は光を受容する球状のLOVドメインとDNAに結合する紐状のbZIPドメインを持つ。暗所でPZの単量体分子はbZIPがLOVに付いた構造をしているが(上段)、光を照射するとLOVからbZIPが離れた構造へ変化している(下段右)。更に、これら分子が2つ集まって二量体を形成する様子も明らかになった(下段左)。
研究の背景
生命は、細胞内で合成されたタンパク質が必要な時に必要な場所で機能することで維持されています。このような生命機能の維持には、転写因子という分子がDNAへ結合して適切な遺伝子を発現しタンパク質の合成を制御することが欠かせません(図2)。ヒトの細胞の核の中にある染色体にはおよそ30億もの塩基対からなるDNA配列に膨大な遺伝情報が含まれており(全長およそ2メートル)、転写因子は、その中からわずか数塩基対(およそ10億分の1メートルの長さ)に結合して遺伝子発現を制御することが分かっています。このような膨大なDNA配列の中から特定の遺伝子をどのように探し出して制御するかはこれまで生命の大きな謎の一つでした。この謎を解く重要な鍵として、多くの転写因子が二量体という2つの分子がペアを形成することが大きく関わっているのではないかと推測されていましたが、その二量体の形成の仕組みは良く分かっていませんでした。そのような中で、近年、藻類の中で枝分かれに関与する転写因子が発見され、更にその分子を改変したPhotozipper(略してPZ)と呼ばれる転写因子は光を使って分子の動作をコントロールできたことから、当該研究グループはこの分子に着目し、転写因子が機能する仕組みを調べるための格好のモデルとして詳細に研究を行いました(図1)。従来の顕微鏡では生きた状態の生体分子の構造や動きを詳細に観察することが出来ないため、研究グループは水溶液中で分子の構造をナノ(10億分の1)メートルの解像度で観察でき、更にその分子の動きも捉えることができる高速原子間力顕微鏡(高速AFM)と呼ばれる新しい顕微鏡を用いて観察を行いました。
図2. 遺伝子発現のプロセスにおける転写因子の役割。細胞の核内にある染色体には生物の機能を維持し形質を決定づける膨大な遺伝子が納まっている。転写因子は、その中で特定の遺伝子を活性化するためのいわばスイッチとなる配列(標的配列)に結合することで、タンパク質をつくるプロセスをスタートさせる。この際、多くの転写因子は二量体を形成していると言われているが、その形成機構はこれまで良く分かっていなかった。
研究の内容
高速AFMでPZ分子を計測したところ、光を受容するLOVドメインと呼ばれる球状の構造部分と、DNAに結合するbZIPドメインと呼ばれる紐状の構造部分を詳細に観察することができました(図1)。暗所ではPZの単量体分子はbZIPがLOVに付いた構造をしていることが分かりました。そこで、PZ分子へ光をあてたところ、LOVからbZIPが離れてLOVのまわりをbZIPの紐状構造が揺らいでいる様子を観察することができました。更にこれらの分子はお互いに衝突すると結合し、二量体を形成しました。転写因子のこのような構造変化や分子動態の計測は世界で初めての成果です。これらの計測をもとにPZの二量体について更に詳しく調べた結果、暗所よりも明所で形成される二量体の方が安定してペア構造が維持されていることが明らかとなりました。LOVとbZIPには二量体を形成する際にそれぞれ結合しやすい部分があることが示されています(図1赤塗部)。前述で発見した光照射下でのPZの分子構造変化により、その結合しやすい部分が露出したことで安定な二量体が形成されたと考えられます。このように本研究により分子の構造変化が二量体形成に重要な役割を果たしていることが明らかとなりました。
本研究成果が社会に与える影響(本研究成果の意義)
転写因子はあらゆる生物に存在し、複雑な細胞機能の制御を担っていますが、その多くが二量体を形成するという共通点を持っています。二量体形成の仕組みの重要な要素を明らかにした本研究の成果は転写因子全般の機能解明の突破口となることが期待されます。またヒトにおいてはがんの増殖や免疫応答など疾患に関わる転写因子も数多く存在しています。それらへ高速AFMを応用することで、その分子メカニズム解明を通して医学・創薬などへの波及効果も期待されます。
特記事項
本研究成果は、2022年8月8日(月)18時(日本時間)に国際学術誌「Scientific Reports」(オンライン)に掲載されました。
タイトル: “Dimerization processes for light-regulated transcription factor Photozipper visualized by high-speed atomic force microscopy”
著者名: Akihiro Tsuji1, Hayato Yamashita1,*, Osamu Hisatomi2 & Masayuki Abe1
(*責任著者)
所属: 1. 大阪大学大学院基礎工学研究科、 2. 大阪大学大学院理学研究科
DOI:https://doi.org/10.1038/s41598-022-17228-6
なお、本研究は、JSPS科研費20H03223、22K18945(山下隼人)、19K06586(久冨修)、19H05789, 21H01812, 21K18876(阿部真之)、JSTさきがけ15654934(山下隼人)、大阪大学大学院基礎工学研究科未来研究ラボシステム、大阪大学研究支援員制度、武田科学振興財団(山下隼人)などの支援により得られたものです。
参考URL
阿部真之教授 研究室
http://www.ae.stec.es.osaka-u.ac.jp/wp/
Researchmap 山下隼人
https://researchmap.jp/10595440
用語説明
- 遺伝子
生物機能に関わるタンパク質を作るための設計図。DNAという物質からできており、その中にある4種類の塩基(アデニン、グアニン、シトシン、チミン)の並び順が遺伝暗号として働く。その暗号で20種類のアミノ酸が連なる蛋白質のアミノ酸の並びが指定される。
- 転写因子
特定のDNA配列に結合し、遺伝子の発現制御を担うタンパク質。ヒトの場合、これまでに約1600種類の転写因子が見つかっている。
- 二量体
タンパク質などの2つの分子がまとまって形成された分子のこと。一つ一つのことは単量体という。
- 高速原子間力顕微鏡
鋭い針(探針)で試料表面を高速に走査することにより物質のミクロな構造とその動きを可視化する顕微鏡。名称は高速AFMと略して呼ばれる。水溶液中の生体分子をナノ (10億分の1) メートルの解像度で観察でき、更にその動きも捉えることができる。
- DNA
細胞の中にある長大な線状の物質。その中に遺伝暗号が含まれており遺伝子として機能する。
