脊椎動物の光を感じる超分子の形成機序を解明
生体膜研究の未知の領域への手がかり
本研究成果のポイント
・動物の目で光を実際に感知するロドプシンは、網膜内の円板膜で列状超分子を形成しています。その機序を実験系研究者と数理科学系研究者が共同で解明しました。
・円板膜のコレステロールと飽和脂質に富むラフト領域がロドプシンを繋ぐ「糊」の役を担い、ロドプシン列状超分子を形成・維持していることを見出しました。
概要
広島大学大学院統合生命科学研究科の粟津暁紀准教授、藤井雅史助教、同大学大学院博士前期学生の金重先人、及び神戸大学バイオシグナル総合研究センターの森垣憲一准教授、同大学大学院理学研究科の林文夫名誉教授、大阪大学大学院基礎工学研究科の山下隼人助教のグループは、動物の網膜桿体細胞内の円板膜において、外界から目に入った光を実際に感知するロドプシンタンパク質 が形成する、列状の超分子構造 の形成メカニズムを明らかにしました。
本研究ではまず、神戸大学・大阪大学のグループが持つ実験・生化学的知見と広島大のグループが持つ数理的知見の融合により、円板膜を構成する脂質とロドプシンの動態の定量的な数理モデルが提案されました。そしてこのシミュレーションにより、まずロドプシンの列状超分子の単位構造となるロドプシン2量体の形状が明らかになり、更に、円板膜上に少量含まれるコレステロールの結合した飽和脂質が形成する「脂質ラフト 」ドメインが、2量体同士間を繋げる「糊」の役割を担うことで、超分子構造が形成・維持されることを見出されました。
本研究の成果はアメリカ東部時間の2020年2月7日14時(日本時間:2020年2月8日4時)「PLOS ONE」オンライン版に掲載されました。
研究の背景
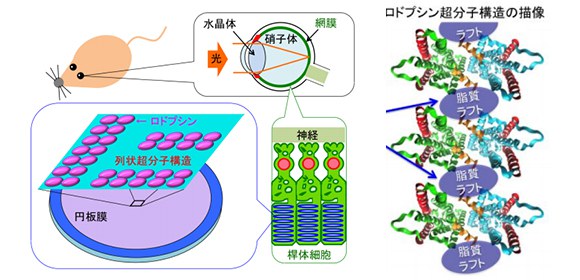
ヒトを含む脊椎動物は外界の景色を、目に入った光を網膜で感知することで認識出来ます。特に外界の明暗を感知するのは、網膜にある桿体細胞であり、その細胞内で実際に光を捉えるのは、内部に数千枚ある脂質円板膜一枚当たりに約1万個刺さっている、ロドプシンと呼ばれるタンパク質です (図1) 。2003年の原子間力顕微鏡を用いたマウスの桿体細胞円板膜の観察 [1] を契期に、近年、ロドプシンは各円板膜内にランダムにいるのではなく、2つの分子の結合体である2量体が多数列状に連なり、超分子構造を形成していると示唆されてきました (図1) 。
しかしこの後約15年、様々な研究が進められつつも、この列状超分子構造が形成されるメカニズムは不明でした。それどころか、そもそも各2つのロドプシンが互いにどのような向きで結合し、列構造の構造単位である2量体を形成しているのか、これまでX線結晶構造解析、クライオ電子顕微鏡、分子動力学シミュレーションにより考察されてきましたが、幾つかの候補 (図2) は挙げられたものの、決定的な答えは得られていませんでした。
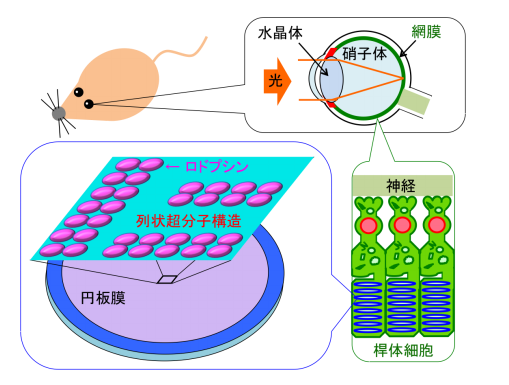
図1 脊椎動物の目の構造、及び網膜桿体細胞内の円板膜における、ロドプシンの超分子構造の概略図。

図2 円板膜におけるロドプシン2量体構造の、有力な2つの候補とされている構造。
ラフト親和的な部分が(左)2量体の中心付近に、(右)2量体の両端に存在しています。円板膜上でどちらの構造を取っているのか、これまで不明でした。
研究成果の内容
ロドプシンが存在する円板膜は、多量の不飽和脂質に加え、少量(脂質の8%程度)のコレステロールと飽和脂質から構成されています。コレステロールと飽和脂質は膜内で脂質ラフトと呼ばれるナノサイズのドメインを形成することが知られ、細胞研究の多くの分野で注目されています。神戸大学の林らは、円板膜でのラフトの存在を初めて報告し、その光信号変換での重要性を指摘しました。また、ロドプシンの2量体化がロドプシンを劇的にラフト親和的にすることを明らかにしてきました。さらに最近、森垣・林グループは、円板膜内でロドプシンが0.1ミクロン大で短寿命のラフト領域を自己組織化していることを発見し、ロドプシン超分子構造形成に2量体化依存的ラフト親和性が重要な役割を果たすことを強く示唆しました [2] 。
しかし2つのロドプシンが互いにどのような向きで結合しているかについての2つのモデル構造を比較すると、強いラフト親和性を持つ部位(ロドプシンの飽和脂肪酸修飾)が、一方では2量体の遠く離れた両端に、もう一方では2量体の中心付近に位置することが分かります (図2) 。つまりロドプシン2量体とラフトドメインの相互作用の詳細は、両モデル間で全く異なると考えられました。
そこで広島大のグループは、神戸大及び阪大のグループの実験上の知見に基づいて、上記2種類のロドプシン2量体モデルについて、それらが不飽和及び飽和脂質からなる脂質2層膜に組み込まれた粗視化分子動力学モデルを構成し、動態をシミュレーションしました。その結果、ラフト親和的な部位をその中心付近に持つロドプシン2量体だけが列状超構造を形成し得ることや、ラフトドメインが2量体を繋ぐ「糊」の役を担うことで、長い列状超分子構造が形成・維持されることが明らかになりました (図3) 。
本研究成果は、科研費基盤B特設分野研究(研究課題「光受容体タンパク質が自発的に作る2次元秩序構造についての構成的研究」、研究代表者:森垣憲一(神戸大学准教授)、研究開発期間:2017年4月~2020年3月)の一環として得られました。
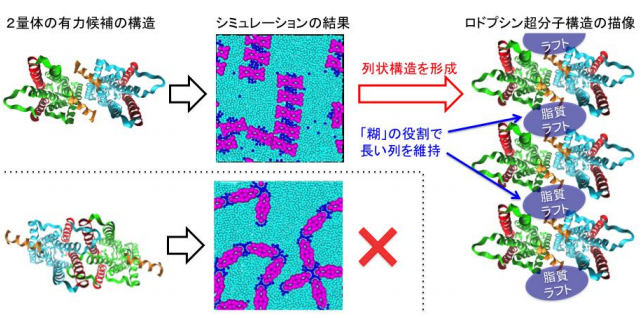
図3 シミュレーションの結果と、そこから結論づけられるロドプシン列状超分子構造の詳細な描像。
ラフト親和的な部分が中心付近に存在するロドプシン2量体のみが、列状超分子構造を形成出来ることを示しています(上段)。この際、脂質ラフトドメインが、長い列を形成・維持するための「糊」の役割を果たしています(右)。
今後の展開
本研究により、ロドプシンがどのようにして列状超分子構造を形成しているのかが明らかとなりました。この知見は、ロドプシンと結合し他の分子に光の情報を伝えるタンパク質にとって、この特異な超分子構造がどのような働きをするのかを明らかにする基盤となります。そして最終的に脳神経に光の情報を効率よく伝えるメカニズムの理解に、繋がっていきます。また本研究成果は、膜タンパク質の自己集合に伴うラフト親和性変化が、どのように自己組織化・超分子構造形成に関与するかについて示しており、蛋白質・脂質の動的な自己組織化や局在決定という生体膜研究の未知の領域に重要な手がかりを与えるものと期待されます。
特記事項
論文タイトル:Affinity of rhodopsin to raft enables the aligned oligomer formation from dimers: Coarse-grained molecular dynamics simulation of disk membranes.
著者:Yukito Kaneshige1*, Fumio Hayashi2, Kenichi Morigaki3, Yasushi Tanimoto2, Hayato Yamashita4, Masashi Fujii1,5, Akinori Awazu1,5# (*筆頭著者、#責任著者)
所属
1. 広島大学大学院理学研究科
2. 神戸大学大学院理学研究科
3. 神戸大学バイオシグナル総合研究センター
4. 大阪大学大学院基礎工学研究科
5. 広島大学大学院統
掲載雑誌:PLOS ONE
DOI 番号:DOI: 10.1371/journal.pone.0226123.
参考URL
大阪大学 大学院基礎工学研究科 附属極限科学センター 阿部研究室
http://www.ae.stec.es.osaka-u.ac.jp/wp/
用語説明
ロドプシン光が当たることによって部分的に形状を変化させるタンパク質。網膜細胞にある脂質円板膜に貫通して存在し、光の認識の初期段階を担う。
超分子構造複数の分子が共有結合以外の結合によって集合し形成された秩序的な構造。
脂質ラフト細胞膜や細胞内の様々な脂質膜に存在する飽和脂質とコレステロールに富むミクロなドメイン。
