指定難病「特発性肺線維症」で高発現する 長鎖非コードRNAの新たな機能を発見
基底細胞を標的とする新たな治療法の開発に期待
研究成果のポイント
- 特発性肺線維症の病態メカニズムの解明につながる長鎖非コードRNAの機能を新発見
- 特発性肺線維症は肺の奥深くで組織が固くなる(線維化する)難治性の進行性肺疾患で、これまでに本来あるべきでない部分に基底細胞が出現し、その基底細胞の増加は予後不良を示すことが分かっていた。
- 特発性肺線維症において長鎖非コードRNAであるMIR205HGが基底細胞において高発現し、炎症性サイトカインIL33をRNAレベルで発現制御することを発見
- MIR205HG Alujbエレメントを標的とし、IL33の発現を抑制する低分子化合物DQzGを同定
- 特発性肺線維症の新たな治療薬として低分子化合物DQzGのさらなる研究・開発に期待
概要
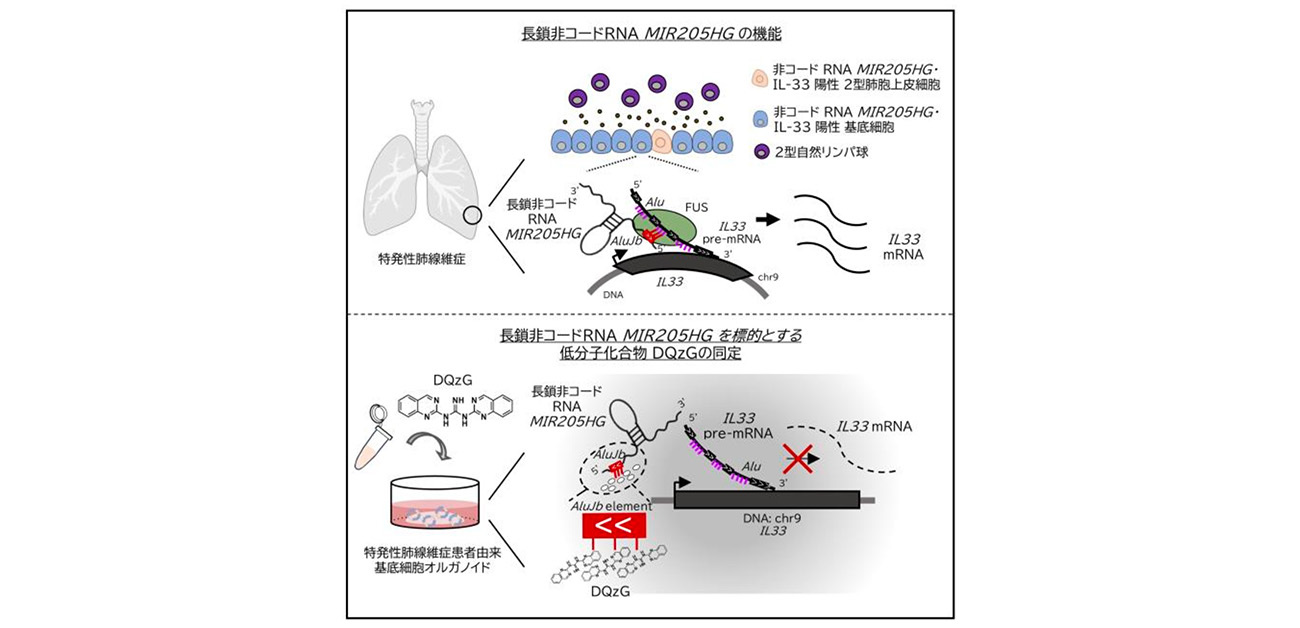
大阪大学大学院医学系研究科 髙島剛志さん(博士後期課程)、森井英一 教授(病態病理学)らの研究グループは、大阪大学産業科学研究所 中谷和彦 教授、大阪大学大学院生命機能研究科 廣瀬哲郎 教授、早稲田大学理工学術院 浜田道昭 教授、千葉工業大学先進工学研究科 河合剛太教授らとの共同研究により、原因不明の肺の病気「特発性肺線維症」において、長鎖非コードRNAであるMIR205HGが基底細胞において高発現し、炎症性サイトカインIL33をRNAレベルで発現制御することを明らかにしました。さらにMIR205HGを標的とする低分子化合物 DQzGがIL33の発現を抑制させることを発見しました。
これまでに、特発性肺線維症では異所性(本来あるべきでない部分)に基底細胞が出現し、その基底細胞の増加は予後不良を示すことが分かっています。しかし、この基底細胞の機能については十分に解明されていませんでした。
今回、研究グループは正常な肺および特発性肺線維症患者における単細胞RNAシークエンス (scRNA-seq)のデータを再解析することで、基底細胞に特異的かつ高発現している遺伝子として長鎖非コードRNA MIR205HGを同定しました。患者由来のオルガノイドを用いた実験やバイオインフォマティクスの解析手法を駆使することで、MIR205HGが炎症性サイトカインIL33の発現をRNAレベルで制御している事が明らかとなりました。さらに、MIR205HGを標的とする低分子化合物を網羅的に調べ、IL33の発現を減少させる低分子化合物DQzGを同定しました(図1)。
本成果によって、特発性肺線維症の病態理解に加え、基底細胞を標的とする新たな治療法の開発につながることが期待されます。
本研究成果は、米国科学誌 「JCI Insight」 に、3月11日(火)午前1時(日本時間)に公開されました。
図1. 本研究の概略図
研究の背景
特発性肺線維症は、肺の奥深くで組織が固くなる(線維化)ことを特徴とする、難治性の進行性肺疾患です。この病気の進行を完全に止める治療薬はまだ開発されておらず、病態メカニズムの解明とそれに基づいた治療法の開発が期待されています。
これまでに、特発性肺線維症では本来ないはずの場所に基底細胞が出現し、その基底細胞の増加は予後不良を示すことが分かっていました。さらに、2022年には基底細胞が細胞外マトリックスを増やし、筋線維芽細胞を活性化させることが初めて報告されました。しかし、病態メカニズムの解明につながる基底細胞の機能については十分に解明されていませんでした。
研究の内容
今回、研究グループは、正常肺および特発性肺線維症患者におけるscRNA-seqデータを再解析することで、基底細胞に特異的かつ高発現している遺伝子として長鎖非コードRNA MIR205HGを同定しました。大阪大学医学部附属病院の特発性肺線維症患者さんのサンプルを用いたMIR205HGの発現量に基づく予後解析では、MIR205HGの高発現群は予後不良を示しました(図2)。これまでに特発性肺線維症において長鎖非コードRNA MIR205HGの病態関与についての既報はなく、新たな病態関与遺伝子として着目しました。
図2. MIR205HGの発現量に基く予後解析
(左) MIR205HG in situ hybridization (ISH) 画像。 陽性細胞 (茶色)、核染色 (青色)
(右) MIR205HG低発現群と高発現群における全生存期間解析。
長鎖非コードRNAは、様々な遺伝子の発現制御に関与するとの報告から、正常肺の肺胞上皮細胞あるいは特発性肺線維症患者由来の基底細胞からオルガノイドを樹立し、MIR205HGの過剰発現やノックダウンの実験を行うことで下流の発現変動遺伝子を探索しました(図3)。さらに、様々なデータベースを用いて発現制御遺伝子を絞り込んだところ、MIR205HGが炎症性サイトカインIL33の発現を制御していることが明らかとなりました。
図3. 特発性肺線維症由来基底細胞オルガノイドを用いたMIR205HGのノックダウン
(左) MIR205HGの発現量 (右) IL33の発現量
そのメカニズムとして、MIR205HGの遺伝子領域内(エクソン領域)に存在するAlujbエレメントがIL33のDNA/pre-mRNA(イントロン領域)と9か所で配列相同性があることが予測されました。そこで実際に、MIR205HG AlujbエレメントがIL33の発現制御において機能的であるのか検討しました(図4)。 MIR205HGの全長ベクターとMIR205HG Alujbエレメントを欠失させたベクターを細胞へ導入すると、Alujbエレメントを欠失させたベクターにおいてIL33の発現の上昇の程度が低いことが明らかとなりました。そこで低分子化合物の処理によって、MIR205HGのAlujbエレメントを標的とし、IL33の発現抑制が可能か試みました。MIR205HGのAluJbエレメントに結合しうる低分子化合物をスクリーニングしたところ、新規の低分子化合物DQzGを同定しました。特発性肺線維症患者由来オルガノイドにDQzGを処理したところIL33のRNAとたんぱくの発現減少を確認しました(図5)。
図4. MIR205HGとIL33たんぱくの二重染色とその発現制御メカニズムの探索に向けて
(左) MIR205HG ISHとIL33 免疫組織化学染色の二重染色。
(右) MIR205HG遺伝子とIL33遺伝子の配列相同性解析。
MIR205HG Alujb エレメントとIL33 Aluエレメントにおいて配列相同性を認めた。
図5. MIR205HGを標的とする低分子化合物 DQzG処理におけるIL33発現
(左) 低分子化合物DQzGの構造。
(右) 特発性肺線維症由来基底細胞オルガノイドにDQzGを処理した際のIL33たんぱくの発現解析。
近年、肺線維化マウスモデルにおいてIL33が2型自然リンパ球(ILC2)を誘導することで線維化を促進することが報告されています。研究グループは特発性肺線維症サンプルにおいて、MIR205HGとILC2との関連について調べることで病態関与の傍証となり得ると考えました。いくつかの検討を重ね、特発性肺線維症患者サンプルにおいて上皮細胞に発現するIL33はMIR205HGの発現と正の相関関係があり、上皮細胞に発現するIL33の高発現は予後不良を示すという結果を得ました。MIR205HGの高発現例ではILC2の数の増加を認め、線維化領域内のMIR205HGとIL33を高発現する細胞の近傍にILC2が存在することも明らかにしました。
本研究成果が社会に与える影響(本研究成果の意義)
本研究により、特発性肺線維症において基底細胞がもたらす病態機構の一端を明らかにしました。今後、基底細胞に高発現するMIR205HGのAlujbエレメントを標的とし、IL33の発現を抑制する低分子化合物DQzGが、特発性肺線維症の新たな治療薬候補となりうることが期待されます。
特記事項
本研究成果は、2025年3月11日(火)午前1時(日本時間)に米国科学誌 「JCI Insight」 (オンライン) に掲載されました。
タイトル:“Involvement of lncRNA MIR205HG in idiopathic pulmonary fibrosis and IL-33 regulation via Alu elements”
著者名:Tsuyoshi Takashima1, Chao Zeng2, Eitaro Murakami3, Naoko Fujiwara4, Masaharu Kohara1, Hideki Nagata5, Zhaozu Feng1, Ayako Sugai3, Yasue Harada3, Rika Ichijo6, Daisuke Okuzaki7,8, Satoshi Nojima1, Takahiro Matsui1, Yasushi Shintani5, Gota Kawai6, Michiaki Hamada2,9, Tetsuro Hirose4,8, Kazuhiko Nakatani3,8 and Eiichi Morii1,8,*(*責任著者)
所属:
1. 大阪大学 大学院医学系研究科 病態病理学
2. 早稲田大学 理工学術院 産業技術総合研究所
3. 大阪大学 産業科学研究所 精密制御化学研究分野
4. 大阪大学 大学院生命機能研究科
5. 大阪大学 大学院医学系研究科 呼吸器外科学
6. 千葉工業大学 先進工学研究科 生命科学専攻
7. 大阪大学 免疫学フロンティア研究センター(IFReC) ヒト免疫学(単一細胞ゲノミクス)
8. 大阪大学 先導的学際研究機構(OTRI)
9. 産業技術総合研究所 生体システムビッグデータ解析オープンイノベーションラボラトリ(AIST CBBD-OIL)
DOI:https://doi.org/10.1172/jci.insight.187172
本研究は、日本医療研究開発機構 (AMED) 次世代治療・診断実現のための創薬基盤技術開発事業 (JP21ae0121049)、日本学術振興会 (T23K27391, T22KJ2201, 22K15093) の研究の一環として行われました。
参考URL
森井 英一 教授 研究者総覧
https://rd.iai.osaka-u.ac.jp/ja/b7bd41effb13e665.html
用語説明
- 長鎖非コードRNA
タンパク質をコードしないRNAの一種 であり、200塩基以上の長さを持つ。遺伝子の発現調節に関与し、細胞の増殖、分化、疾患の進行などに影響を与えるRNA。
- 基底細胞
肺の基底細胞は、気道の上皮細胞の最下層に位置し幹細胞としての機能を担う。
- MIR205HG
長鎖非コードRNA(lncRNA)の一種であり、マイクロRNA miR-205をコードする。肺がんを含むいくつかのがん種において病態の進行に影響を与えることが知られている。
- Alujbエレメント
Aluエレメントは、ヒトのDNAに存在する短い反復配列(300塩基対程度)であり、レトロトランスポゾン(移動するDNA)の一種である。Alujbエレメントは、このAluエレメントのサブタイプに分類される。
- 単細胞RNAシークエンス (scRNA-seq)
1つ1つの細胞の遺伝子発現を個別に解析する技術であり、従来のバルクRNAシークエンス(多細胞をまとめて解析)と異なり、細胞ごとの遺伝子発現の違いを明らかにできる手法。
- オルガノイド
試験管内で3D培養され、特定の臓器の構造や機能を模倣する組織や集合体のこと。
- 2型自然リンパ球(ILC2)
アレルギー反応や炎症応答に関与する免疫細胞の一種。サイトカインによって活性化されることが知られている。
