0.01%の稀少細胞を検出! 従来比1000倍の細胞100万個を同時観察する“トランススケールスコープ”を開発
スケール階層を越えて生命システムを理解する次世代生物学のツール
研究成果のポイント
- センチメートルを越える大視野(1.46x1.01 cm2)の中の個々の細胞を動態観察できる光学イメージング法を開発。多細胞集団のセンチメートルスケールの動態と、集団を構成する個々の細胞のマイクロメートルスケール動態・機能の同時観察を実現。
- 10万〜100万個の多細胞の中で、0.01%しか存在しないユニークな稀少細胞・イベントの検出を実現。
- 従来の生物顕微鏡での細胞観察は103個程度まで、視野は数mm程度までであった。超多画素カメラとマシンビジョン用マクロレンズを採用することにより、上記の性能が可能に。
- 強力な細胞計測ツールとして、多細胞システムの動作メカニズムを理解するための基礎研究から、人工細胞シートなどの品質管理のような医療応用まで、幅広い貢献に期待。
概要
大阪大学産業科学研究所の永井健治教授、大阪大学先導的学際研究機構超次元ライフイメージング研究部門の市村垂生特任准教授(常勤)(兼任:科学技術振興機構さきがけ研究者)らの研究グループは、1センチメートルを越える大視野の中の個々の細胞動態を観察できる光イメージング法の開発に成功しました(図1)。細胞粒度で観察できるイメージング装置としては、世界最大の視野1.46x1.01 cm2を有していて、10万から100万にものぼる数の細胞を一つの視野の中で瞬時に撮像することができ、全ての細胞の動態(変位、機能発現、状態変化など)を動画として観察することができます。また、機械学習などの画像解析を用いることにより、多数の細胞の中に潜む、極めて稀少な(0.01%以下の)細胞を検出できることを明らかにしました。
このように細胞集団全体のセンチメートルスケールでの動態と、それを構成する個々の細胞のマイクロメートルスケールの動態を、スケール階層を跨いで同時に観察できることから「トランススケールスコープ」と称しました。とくに今回開発した装置はAMATERAS(A Multiscale/Multimodal Analytical Tool for Every Rare Activity in Singularity)と命名しました。
本研究成果は、米国科学誌「Scientific Reports」に、8月17日(火)に公開されました。
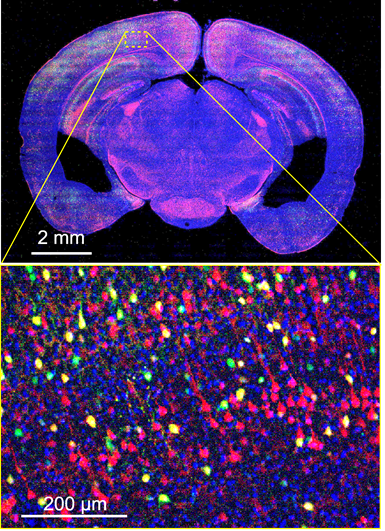
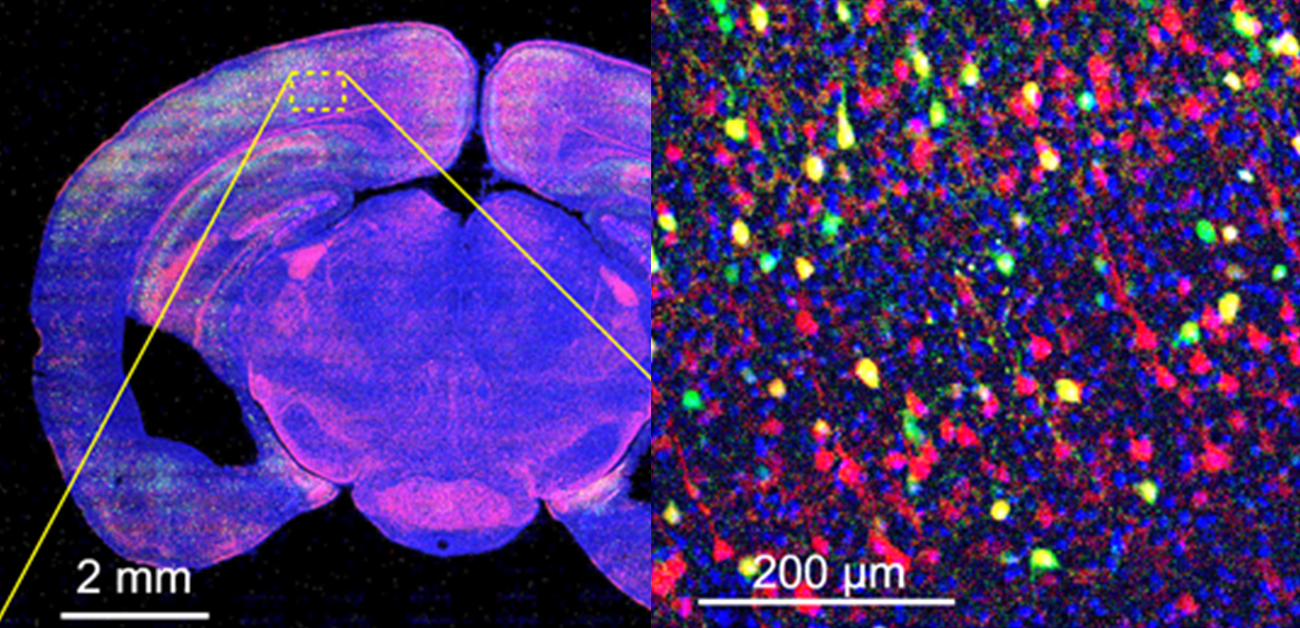
図1. マウス脳のトランススケールイメージング.
(上段)興奮性投射神経細胞を赤色蛍光タンパク質で、抑制性介在神経細胞を緑色蛍光タンパク質で、細胞核をヘキスト33342で青色に染色したマウス脳の環状断をワンショット撮影した画像。
(下段)上段の黄色破線枠をデジタル拡大した画像。
本研究の成果
私たちは、生物顕微鏡で使われているカメラとレンズから離れ、異なる分野で使われているレンズとカメラに着目しました。それは、マシンビジョン分野で用いられているものです。マシンビジョン用で用いられるカメラは、生物用に比べて画素数が非常に大きいものがあり、1億画素を超えるCMOSカメラも市場に出回っています。また、そのセンサーサイズも生物顕微鏡よりも大きいサイズのものが存在します。レンズについては、これらの大型のCMOSセンサーに対応したレンズが存在します。本研究での目的を達成するためにカメラとレンズを選定した結果、1.2億画素CMOSセンサーと倍率2倍のテレセントリックマクロレンズを組み合わせるアイデアに至りました。
図2は、これらのレンズとカメラを用いて、生細胞の蛍光イメージングを実現するために構築した装置の概略図です。テレセントリックマクロレンズと1.2億画素CMOSカメラを直結して、試料下側から観察する配置です。蛍光観察のために3色の高輝度LED光を備えていて、これらを試料の斜め下から入射することで試料中の蛍光を光らせます。斜めに入射することで、LED光が観察用のレンズに入らないようになっています。これにより、背景光の少ない蛍光観察が可能となります。
図3は、蛍光ビーズ(緑色、200nm直径)を視野全域に散布して、観察した結果です。視野サイズは1.46x1.01 cm2で、視野の中心でも辺縁部でも同等のイメージング性能が得られているのが分かりました(図3b)。空間分解能はこの波長でおよそ2.3µmであることが分かりました。これは理論値とほぼ一致していて、単細胞を空間分解して観察するのに十分な分解能です。
図4は、細胞を観察した例です。上皮細胞(MDCK細胞)の核をNucleoSeeingという色素で染色し、これを白色光の透過光(図4a上)と緑色の蛍光(図4a下)で観察しました。 視野全域でほぼ同様のクオリティの画像が得られています。画像解析により視野内の細胞数(核の数)をカウントした結果、このケースでは119万細胞を同時に観察できることが分かりました。撮像時間は透過光像、蛍光像とも1秒でした。つまり、たった1秒の時間で100万を超える細胞を同時に観察することができるのです。これは、一般的な顕微鏡観察よりも遙かに多いのみならず、フローサイトメトリーという速さが売りの細胞解析法と比べても、多数の細胞を瞬時に解析できることを意味しています。しかも、本手法はイメージングですので、細胞の空間分布や経時変化の情報を得ることが出来るため、情報リッチな細胞計測法(サイトメトリー)として有望な手法であると言えます。
この方法によって、稀少な細胞を検出できることを実証するために、HeLa細胞のカルシウムイメージングを実施しました(図5)。
カルシウムインジケータ蛍光タンパク質であるYellow Cameleon 3.60 (YC3.60)が発現するHeLa細胞を、ガラス基板上で培養し、そのカルシウム動態を動画として観察しました。この結果、視野全域でおよそ12万個あるHeLa細胞のうち、ごく一部の細胞が自発的にカルシウムイオン濃度上昇を起こす現象が観察されました。具体的には、1000秒の観察の間に394個の細胞でカルシウムイオン濃度上昇が起こりました。これはある瞬間(5秒=動画1フレーム)では、たった2細胞のみでこの現象が起こっていることに相当し、0.0017%の稀少な細胞または現象の検出に成功したことになります。
論文では、上記のほか、細胞性粘菌の細胞が集合して、多細胞体を形成する過程の経時観察を実施し、その中で特殊な振る舞いをする稀少細胞を検出する取り組みについて紹介しました。その稀少細胞が、多細胞体形成を誘導するメカニズムについての詳細な議論は別の論文に記述しました(Kakizuka, T. et al. “Cellular logics bringing the symmetry breaking in spiral nucleation revealed by trans-scale imaging.” bioRxiv 2020.06.29.176891 (2020).)。
このような大量(105~106個)の細胞をライブ観察することで、稀少細胞に関する既存の謎を解明するとともに、新たな研究対象を発見することができると考えています。これを推進するためには、装置が広く普及している必要があります。上で触れたようにAMATERASは、主に市販品のレンズとカメラで構成されたシンプルなシステムです。この特徴により、小規模な研究室でも簡単に導入でき、一般の生物学者が構築するのもそれほど難しくありません。また、本システムのカスタマイズには、高度な光学的専門知識を必要としないため、個々の研究者の研究対象に応じた変更が可能です。この強力なツールを生物学研究室に効果的に普及させることができ、新しい科学分野の創出に貢献できると期待しています。
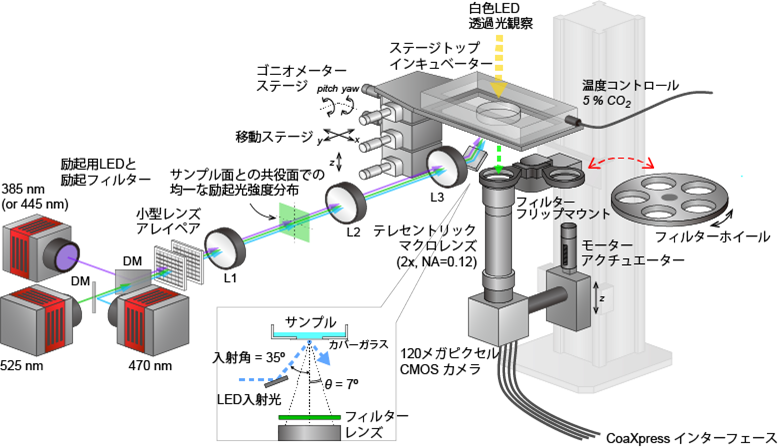
図2. 開発した装置の概要図
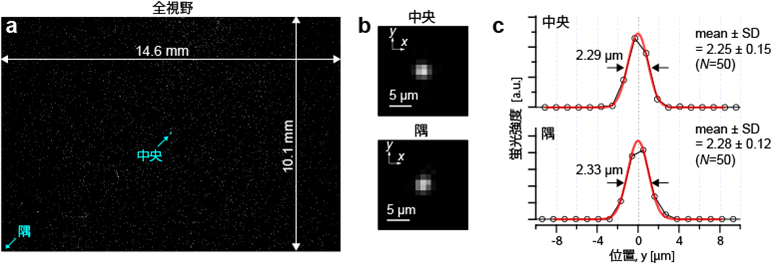
図3. 光学特性
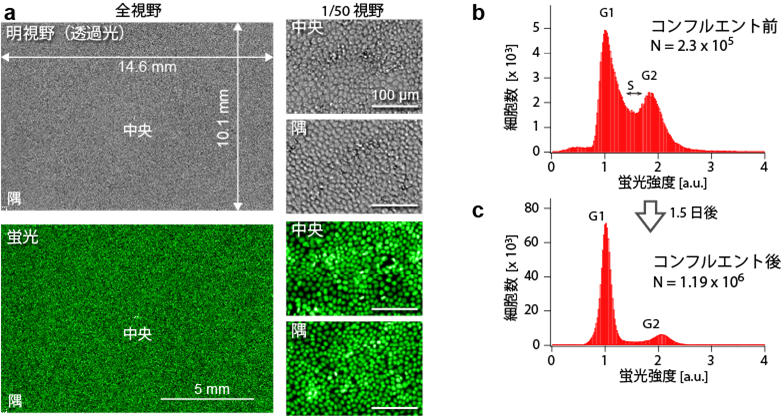
図4. 上皮細胞の観察例
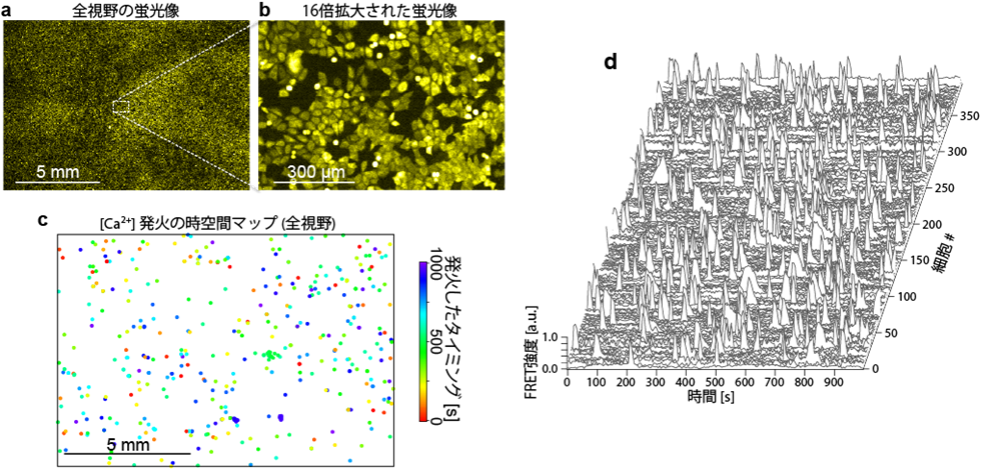
図5. HeLa細胞のカルシウムイメージング
本研究成果が社会に与える影響(本研究成果の意義)
本研究成果の直截的な目的は、多細胞システム理解のための基礎研究からのニーズに応えることですが、多細胞システム研究は、健康社会の実現という社会的ニーズに応えるための取り組みでもあります。これはSDGs第3目標「すべての人に健康と福祉を」の実現への取り組みともいえます。癌変異やウイルス感染などの病態のメカニズムの研究や、予防・治療のための創薬は、多細胞システム研究が下支えとなっています。また、近年の再生医療は日進月歩で発展し臨床研究が進んでいる一方で、今後更なる良質な人工組織の作製法の創出のためには、多細胞システム研究の観点から仕組みを理解することが求められています。この潮流に対して、計測機器メーカーや顕微鏡メーカーにより新技術が開発されつつありますが、現時点において、私たちのAMATERASのように、システム全体から細胞内の分子レベルまで幅広いスケール階層をまたいで統合的に理解できる技術は、世界を見渡しても存在していません。基礎研究から、医療応用までの幅広い波及効果が期待されます。
光イメージング関連の産業に対しても影響が予測されます。近年、広視野イメージング技術として様々な技術が提案されていますが、私たちが開発した方法は、細胞単位の分解能を有するレンズとしては世界最大の視野を有しており、今後新たな派生技術を生み出す可能性を持っています。多細胞システム研究の様々な技法(オプトジェネティクス、各種オミックスなど)との融合のための新規プラットフォームとなる可能性を有していて、大手顕微鏡メーカーも巻き込んで、新たな技術開発の潮流と新たな市場の創出にも繋がることが期待されます。
特記事項
本研究成果は、2021年8月17日(火)に米国科学誌「Scientific Reports」(オンライン)に掲載されました。
タイトル:“Exploring rare cellular activity in more than one million cells by a transscale scope”
著者名:T. Ichimura, T. Kakizuka, K. Horikawa, K. Seiriki, A. Kasai, H. Hashimoto, K. Fujita, T. M. Watanabe, and T. Nagai
DOI: https://doi.org/10.1038/s41598-021-95930-7
なお、本研究は、文部科学省科学研究費助成事業新学術領域研究「シンギュラリティ生物学」、科学技術振興機構(JST) 戦略的創造研究推進事業 さきがけ 「量子技術を適用した生命科学基盤の創出」研究領域 研究課題名「音響フォノン計測で拓く超次元力学イメージング」、物質・デバイス領域共同研究拠点の支援を得て行われました。
参考URL
大阪大学産業科学研究所永井研究室
https://www.sanken.osaka-u.ac.jp/labs/bse/
大阪大学先導的学際研究機構超次元ライフイメージング研究部門
https://transdimension.otri.osaka-u.ac.jp/
用語説明
- マシンビジョン
産業分野において自動検査やプロセス制御、ロボットのガイドに利用され、イメージング、自動画像処理、出力のプロセスによって構成される。
- CMOSカメラ
相補性金属酸化膜半導体を撮像素子に利用したカメラのこと。デジタルカメラやスキャナーの撮像素子として利用されている。
- 上皮細胞(MDCK細胞)
皮膚や粘膜などの上皮組織を形成する細胞のこと。
- フローサイトメトリー
蛍光標識した細胞を懸濁させた液体を細胞が一列になるように流れている状態にし、そこに励起光を照射して発生する蛍光を測定し、蛍光信号に基づいて細胞一つ一つを自動的にサンプリングする方法。
- HeLa細胞
ヒトの子宮頸がん由来の不死化細胞株。
- カルシウムイメージング
細胞の機能を制御する細胞内セカンドメッセンジャーであるカルシウムイオンの動態を単離された細胞、組織内で顕微観察すること。
