膵臓がんのバリアを攻撃して、難治性がんを制圧
がん間質をターゲットにした新たな放射線療法
研究成果のポイント
・がん間質をターゲットにした新たなコンセプトの治療薬を阪大と独ハイデルベルク大で共同開発。
・がん間質はがん細胞の増殖に必要な環境を作るとともに、抗がん剤が届くのを防ぐバリアにもなっている。
・飛程の短い放射線(アルファ線)でがん間質を攻撃することで、がん細胞の増殖を抑制。
・通常の治療が効かない難治性膵臓がんに対する画期的な治療となることが期待される。
概要
大阪大学放射線科学基盤機構(篠原厚機構長)の渡部直史助教(医学系研究科核医学)らの研究チームは、がん細胞の周囲にあるがん間質 をターゲットとした新たなアルファ線 治療薬(アクチニウム標識線維芽細胞活性化タンパク質阻害剤([Ac-225] FAPI-04)) の開発に成功しました。
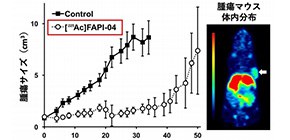
今回、開発した治療薬を膵臓がんのモデルマウスに投与したところ、腫瘍への選択的集積ならびに増殖抑制効果が確認されました (図1) 。がん間質はがん細胞の増殖に必要な環境を作るとともに、がん細胞に抗がん剤が届くのを防ぐバリアにもなっています。今後、通常の治療が効かない難治性の膵臓がんに対する画期的な治療法となることが期待されます。本治療薬は大阪大学と独ハイデルベルク大の共同研究によって開発されました。
本研究成果は、米国科学誌「Journal of Nuclear Medicine」に、10月5日(日本時間)に公開されました。
研究の背景
近年、治療効果が高く、周囲の正常細胞への副作用が少ない放射線であるアルファ線を用いた治療が注目を集めています。これまでのアルファ線治療薬はがん細胞表面に現れる特定の分子をターゲットにしてきました。しかし、それらの分子はがん種によって異なることが多く、転移した部位では発現の程度が異なることがありました。また特に膵臓がんでは、がん細胞の周囲に存在する間質がバリアとなって、がん細胞まで抗がん剤が行き渡らないことがありました。加えて膵臓がんではこのがん間質の成分が多いため、既存の治療があまり効かない難治性となることが多く、新たな治療戦略が必要でした。
図1 [Ac-225] FAPI-04の投与後の増殖抑制効果(左)と膵臓がんモデルマウスにおけるPET診断薬[Cu64] FAPI-04の腫瘍(矢印)への集積画像(右)
本研究の成果
研究グループでは、独ハイデルベルク大学(Frederik Giesel教授ら)との共同研究によって、多くのがん種の間質に発現しているFAP(線維芽細胞活性化タンパク質: Fibroblast Activation Protein) に注目し、がん間質をターゲットにしたアルファ線治療薬の開発に成功しました。
アルファ線治療薬としては、これまで大阪大学では核物理研究センターの大型加速器を用いて、短寿命(半減期=7.2時間)のアスタチン(At-211)を製造し、甲状腺がんなどの治療薬を開発してきました。今回、アクチニウム(Ac-225)という比較的寿命の長い(半減期=10日)アルファ線放出核種を用いて、新たな治療薬(アクチニウム標識FAP阻害剤([Ac-225] FAPI-04)の開発に成功しました。
本治療薬を膵臓がんモデルマウスの静脈内に単回投与したところ、腫瘍に選択的に集積し、腫瘍の増殖抑制効果が認められました。がん細胞の増殖を支えているがん間質をアルファ線で攻撃することで、治療効果が得られることが世界で初めて確認されました (図2) 。今後、本治療薬の最適化を行い、将来的には難治性膵臓がんの患者さんにとって、有効な治療となることを目指しています。
図2 がん間質のがん関連繊維芽細胞(青色)とがん細胞(茶色)のシェーマ:治療薬[Ac-225] FAPI04(赤丸)は間質からアルファ線を照射
本研究成果が社会に与える影響(本研究成果の意義)
がん患者の生存率は全体として上昇傾向にありますが、膵臓がんの5年相対生存率は10% a) と依然としてかなり低い水準が続いており、既存の治療法の有効性は限られています。本研究成果として開発に成功したアクチニウム標識FAP阻害剤は多発転移に対しても投与可能であり、難治性膵がんにおける画期的な治療法となることが期待されます。さらにFAPは膵臓がん以外にも多くのがん種で発現していることがわかっています。将来的には他のがん種に対する治療の有効性も検証し、がん治療戦略の1つに位置づけることを目標にしたいと考えています。
a)国立がん研究センター2009-2010年5年生存率集計報告書より
特記事項
本研究成果は、2019年10月5日(日本時間)に米国科学誌「Journal of Nuclear Medicine」(オンライン)で掲載されました。
【タイトル】
“Theranostics targeting fibroblast activation protein in the tumor stroma: 64 Cu- and 225 Ac-labelled FAPI-04 in pancreatic cancer xenograft mouse models.”
【著者名】
渡部直史 1,2* , Liu Y 1 , 兼田加珠子 2,3 , 白神宜史 2 , Lindner T 4 , 大江一弘 1,2 , 豊嶋厚史 2 , 永田光知郎 5 , 下瀬川恵久 2,6 , Haberkorn U 4,7,8 , Kratochwil C 4 , 篠原厚 2,9 , Giesel F 2,4 , 畑澤順 2,10 .(*責任著者)
【所属】
1.大阪大学 大学院医学系研究科 核医学
2.大阪大学 放射線科学基盤機構
3.大阪大学 大学院理学研究科附属 基礎理学プロジェクト研究センター 医理連携教育研究拠点
4.独ハイデルベルク大学病院 核医学科
5.大阪大学 放射線科学基盤機構附属ラジオアイソトープ総合センター
6.大阪大学 大学院医学系研究科 医薬分子イメージング学寄附講座
7.Clinical Cooperation Unit Nuclear Medicine DKFZ(独ハイデルベルク)
8.Translational Lung Research Center Heidelberg(独ハイデルベルク)
9.大阪大学 大学院理学研究科 化学専攻
10.大阪大学 核物理研究センター
本研究は、日本学術振興会(JSPS)科研費研究(基盤B:19H03602)ならびに科学技術振興機構(JST)産学共創プラットフォーム共同研究推進プログラム(OPERA)の一環として行われました。またアクチニウム( 225 Ac)は日本原子力研究開発機構および東北大学金属材料研究所と放射線科学基盤機構とのウラン233協力プロジェクトによって提供されました。
またFrederik Giesel教授(独ハイデルベルク大学病院)は2019年3月より、クロスアポイントメント制度によって大阪大学放射線科学基盤機構の特任教授に就任しており、本共同研究を加速させることができました。本研究の論文発表は同制度により促進された画期的な成果と言えます。
さらに、大阪大学では量子アプリ共創コンソーシアム(QiSS)において、現時点で国内での大量製造が困難なアクチニウム( 225 Ac)の安定供給に取り組んでおり、アルファ線核医学治療における基盤のさらなる充実化を目指しています。
研究者のコメント(渡部助教)
本治療薬はがんのバリアである間質をターゲットにした新たなコンセプトの治療薬であり、従来の治療が効かない進行がんであっても、治療効果が期待できます。またアルファ線は飛程が短いため、外来通院で投与が可能であり、患者さんの負担が少ない治療になることが見込まれます。難治性膵臓がんの患者さんにとって有効な治療選択肢となるように治療薬の最適化と臨床応用を目指します。
参考URL
大阪大学 大学院医学系研究科 核医学講座HP
http://www.med.osaka-u.ac.jp/pub/tracer/index-jp.htm
用語説明
- がん間質
がん細胞の周囲に存在し、様々な細胞から構成されがんの細胞が増殖しやすい環境を作っている領域。膵臓がんでは多く認められており、バリアとなって抗がん剤が届きにくくなることがある。
- アルファ線
近年、短い飛程でエネルギー(治療効果)の高い放射線として、治療利用が進んでいる。アルファ線を出す薬をがん病巣に選択的に集めることで、周囲の組織には影響を与えることなく、がんの治療が可能。
- アクチニウム標識線維芽細胞活性化タンパク質阻害剤([Ac-225] FAPI-04)
独ハイデルベルク大学で開発されたがん間質に集まる化合物(FAPI-04:Fibroblast Activation Protein Inhibitor)にアルファ線放出核種であるアクチニウム(Ac-225)を標識して作られる治療薬。
- FAP(線維芽細胞活性化タンパク質: Fibroblast Activation Protein)
がん間質の主要成分であるがん関連繊維芽細胞に発現しているタンパク質であり、今回の治療ターゲット。膵臓がんの間質で多く発現が認められる。
