「見る」観察から「見て聞く」観察へ
目と耳を持つタンパク質反応解析装置を世界で初めて開発
本研究成果のポイント
■世界初、タンパク質間の反応を音と光で計測
■アルツハイマー病の原因タンパク質が、従来考えられてきたよりも100倍以上速く毒性の高い構造へ変態することを発見
■「見る」観察から「見て聞く」観察へ。創薬や診断分野への決定的な貢献が期待される
リリース概要
基礎工学研究科の荻博次准教授、蛋白質研究所の後藤祐児教授らの研究グループは、タンパク質間の反応の様子を音により「聞き取り」、かつ、光を利用して分子レベルで「見る」という装置の開発に成功しました。目と耳を持つタンパク質解析装置の誕生です。特殊な目印を付けないと見えないタンパク質でも、その「足音」から存在を知り得ます。この装置を用いて、アルツハイマー病の原因タンパク質の構造変化を調べたところ、「見えない」構造のタンパク質が忍び寄り、突如として毒性の高い「見える」構造へと変化することが分かりました。そして、この構造変化はとても速く、これまで考えられていたよりも100分の1以下という短時間に起こることを発見しました。
研究の背景
タンパク質間の反応を詳しく調べることは、創薬分野においてとても重要です。例えば、ある疾患の原因タンパク質(標的)が特定できたとき、そのタンパク質と高い親和性を示す(強く結合する)タンパク質が薬剤候補として探索されます。標的に結合し、標的の機能を低下させたりするのです。標的は細胞の中や細胞膜に存在する場合も多いです。したがって、タンパク質が「どの部位にどの程度の結合力で」標的と結合するかを知ることは、そのタンパク質の薬剤としての能力を評価する上で非常に重要な情報です。
現在、タンパク質の挙動を分子レベルで観察するには蛍光顕微鏡が用いられています。目的のタンパク質に、蛍光物質の目印を取り付け、その目印を発光させて顕微鏡下で動きを追うのです。しかし、この方法では、目印が付いていないタンパク質の動きを捉えることはできませんし、タンパク質間の結合の強さを評価することもできません。また、アルツハイマー病の原因タンパク質のように、自己凝集して様々な構造を作るタンパク質においては、全ての構造に付加することのできる蛍光物質は無く、ある特定の構造のものしか見ることができません。しかし、「見えない」構造こそがアルツハイマー病の発症に強く関わっているとも考えられています。
そこで私たちは、無色透明の「水晶のマイクロ・ベル」上でタンパク質の反応を起こし、ベルの音色によって、その反応の性質を聞き取り、同時に、ベル上に限定的な光の領域(エバネッセント領域)を作り、タンパク質の動きを分子レベルで観測するという装置を世界で初めて開発することに成功しました。「見える」タンパク質は顕微鏡によって観測し、「見えない」タンパク質の挙動は、ベルの音色によって「聞き取る」のです。音色の変化は、溶液に溶け込んでいたタンパク質がベルの表面のタンパク質と結合し、反応したことを知らせてくれます。音色の変化の速さから、タンパク質間の親和性もわかります。音を使用するため、見える必要はないのです。
これまでにも、タンパク質間の親和性を計測する装置を蛍光顕微鏡へ融合する試みがなされてきましたが、原理的な困難さのために達成されませんでした。それは、これまでのチップ上には金属コーティングが存在しており、これが光の透過を妨げてしまうからです。そして、この金属コーティングは従来の解析装置においては不可欠であったのです。
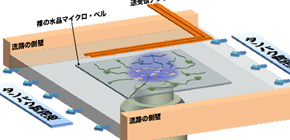
そこで、私たちは、極めて光透過性の高い無色透明の水晶を溶液中に設置して、アンテナによって遠隔的にその音色を計測するという手法を世界で初めて確立し、蛍光顕微鏡との融合を成し遂げました。 図1 に装置の概要を示します。
タンパク質溶液の流れの中に、厚さ28μmの水晶のマイクロ・ベルを置き、流路の外側に2本のアンテナを設置します。これらは、マイクロ・ベルの振動の励起と検出を非接触で行います。ベルの下方より光を照射し、ベルの上面の限定した領域にエバネッセント場を作ります。この領域に入ってきたタンパク質のうち、蛍光物質が付与されたものは発光し、その動きが観測できます。一方、ベル表面上のタンパク質と反応するため、溶液から出てきたタンパク質の分子数は、ベルの音色の変化からリアルタイムに計測されます。ベルの表面にタンパク質が吸着すると、ベルがわずかに重くなり、音色が変わるためです。
この装置を用いて、アルツハイマー病の原因タンパク質の凝集反応を観測したところ、まず「見えない」構造のタンパク質がベル表面に生成され、長い時間が経過した後、突如として「見える」線維状の構造が大量に形成されることがわかりました。「見えない構造」から「見える構造」への変態と考えられます。驚くべきことに、この線維状の構造が成長する速度は、これまで考えられてきた速度の100倍であることが分かりました。これは、このタンパク質の凝集反応の理解に根本的な影響を与える結果です。
本研究成果が社会に与える影響(本研究成果の意義)
これまで、視覚情報と定量性を兼ね備えた計測システムは存在しませんでした。例えば、細胞内のある器官付近にあるタンパク質が多く観測されたとしても、それらが強固に結合しているかどうかは、視覚情報だけでは知り得ません。また、蛍光物質を付加できないタンパク質や、形態が変化して蛍光物質が付着できないタンパク質も多く、「目」だけでタンパク質の反応を追うことには限界がありました。今回、「耳」の機能を付加したことにより、タンパク質反応の理解が飛躍的に深まり、結果、疾患メカニズムの解明や創薬への貢献が期待されます。
特記事項
本研究成果は、英国時間11月7日(金)に英国科学雑誌「サイエンティフィック リポーツ」オンライン版で公開されました。
参考図
参考URL
用語説明
- 全反射
光が屈折率の低い媒質から進行し、屈折率の高い媒質との界面において反射する場合を考えます。界面に対して垂直に近い角度から光が入射するとき、一部は界面で反射し、一部は屈折率の高い側へ折れ曲がって透過します。ところが、界面に対して十分に浅い角度から入射すると、光のエネルギは全て界面で反射し、屈折率の高い媒質側へは進行してゆきません。この状態を全反射と呼びます。
- エバネッセント場
光が全反射するとき、屈折率の高い側へのエネルギの伝播は起こりませんが、界面近傍では、少しだけ、屈折率の高い側へのエネルギの漏れ領域が発生します。この領域をエバネッセント場と呼びます。光のエネルギが、界面にごく近傍に局在しますので、この部分に侵入してきた蛍光物質だけを光らすことができ、一分子計測を可能とします。
