過飽和によるアミロイド線維形成の抑制を解明
高齢者に多いアミロイド病の予防に貢献する新概念
研究成果のポイント
概要
大阪大学国際医工情報センターの後藤祐児特任教授のグループは、大阪大学蛋白質研究所の大学院生の野地真広さん(令和2年3月理学研究科博士課程修了、現在、京都大学人間・環境学研究科、研究員)、神戸大学、鳥取大学、産業技術総合研究所、エトヴェシュ・ロラーンド大学(ハンガリー)、ユニバーシティ・カレッジ・ロンドン(イギリス)、ミュンヘン工科大学(ドイツ)、オーフス大学(デンマーク)と共同で、蛋白質が機能的な天然(ネイティブ)構造を形成するか、あるいはアミロイド病の原因となるアミロイド線維を形成するかの分かれ目が、何によって決まっているのかを蛋白質科学の手法で研究しました。
アミロイド線維は高齢化社会の深刻な問題であるアルツハイマー病やパーキンソン病など一連のアミロイド病の原因物質として世界で研究が進んでおり、特に最近はクライオ電顕や固体NMRなどの構造解析によって原子レベルの立体構造が次々と明らかになってきています。他方、アミロイド線維の形成機構の詳細は不明です。
今回、後藤特任教授らのグループは、2つの反応が過飽和によって制御されていること、そして過飽和はアミロイド線維形成を抑制していることを明らかにしました。「過飽和はアミロイド線維の形成を抑制する」という新たな視点は、アミロイド病の予防や治療の発展に貢献すると期待できます。
本研究成果は、Nature Researchが提供するオープンアクセス・ジャーナルCommunications Biologyに2021年1月26日(火)19時(日本時間)にオンライン出版されました。
研究の背景
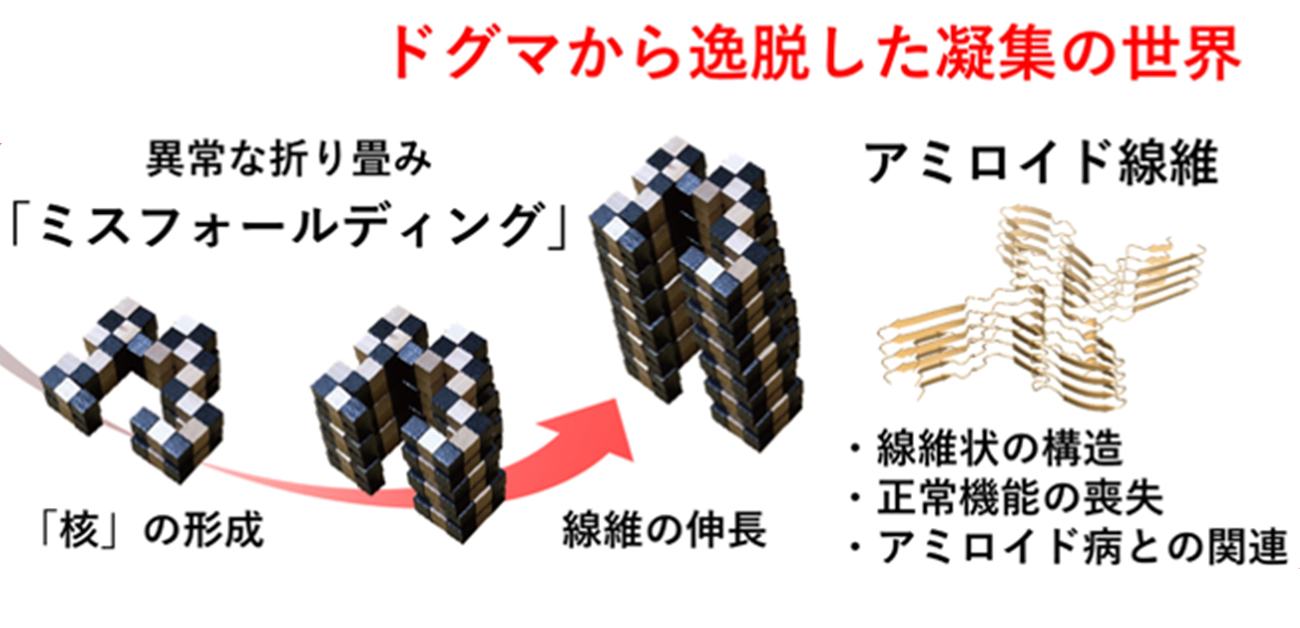
アミノ酸が一次元につながった高分子鎖である蛋白質は、「アンフィンセンのドグマ」に従い、フォールディングして機能します。一方、蛋白質はアミロイド線維と呼ばれる針状の凝集体を形成することがあります。アミロイド線維の形成は、フォールディングと対比して「ミスフォールディング」と呼ばれます(図1)。アミロイド線維は、アルツハイマー病やパーキンソン病、透析アミロイドーシスなどのアミロイド病の発症に関与します。また、病気と関係しない卵白リゾチームなどの蛋白質もアミロイド線維を形成します。
フォールディングとアミロイド線維形成の関係は組木パズルでうまく表現できます(図1)。現在、アミロイド線維の原子構造が次々と明らかになっています。しかし、フォールディングとミスフォールディングの分かれ目を何が決めるのかは不明でした。
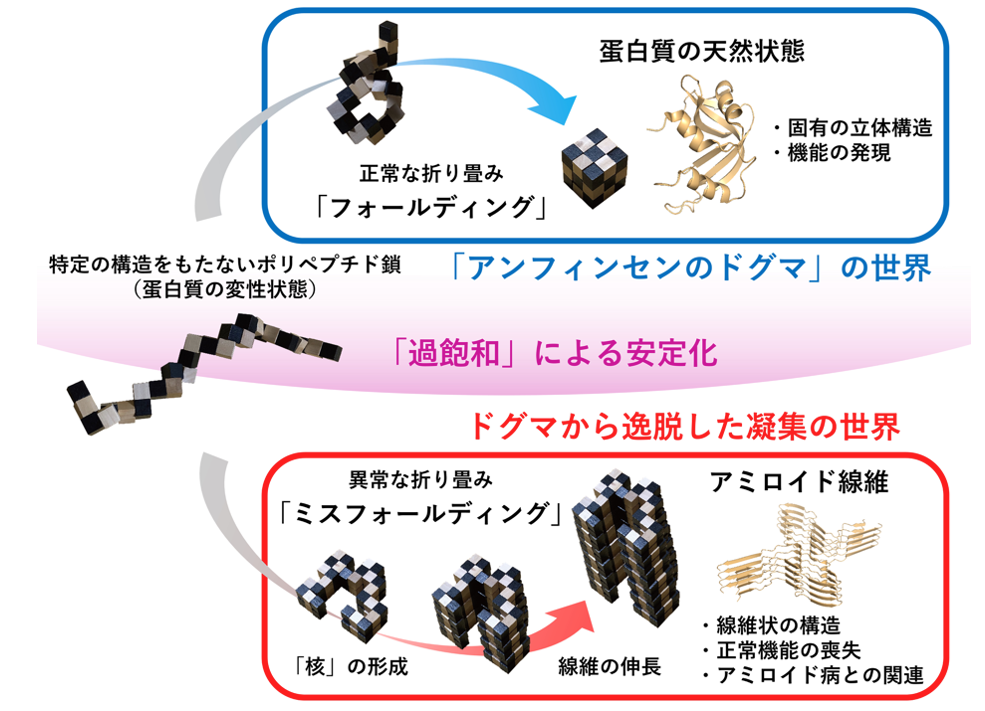
図1 蛋白質のフォールディング(「アンフィンセンのドグマ」の世界)とアミロイド線維形成(ドグマから逸脱した凝集の世界)の組木モデルを用いたイメージ。
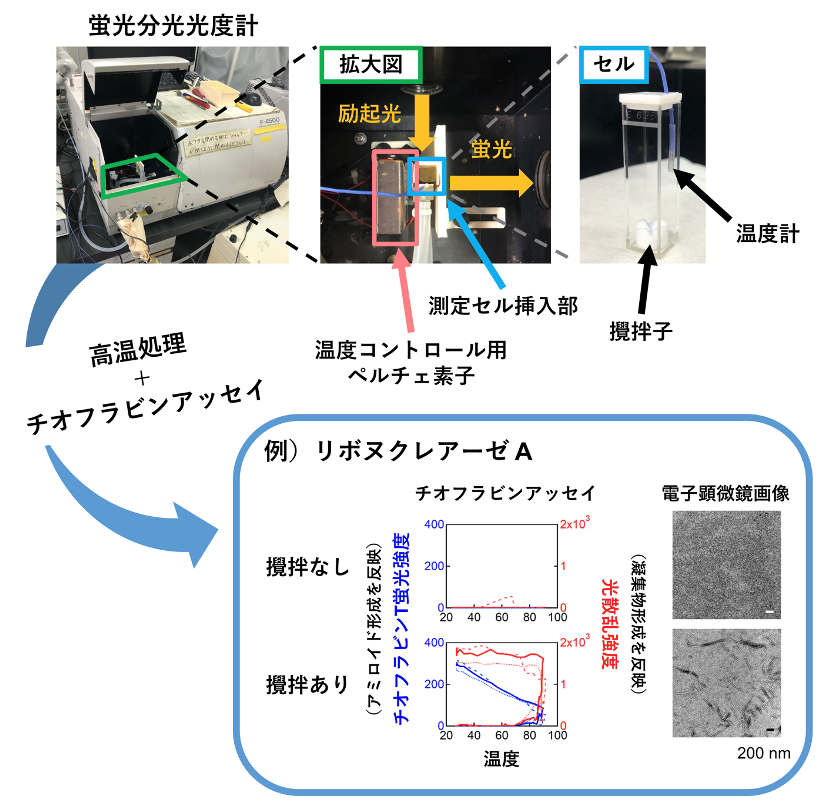
図2 実験の概要。十数種類の蛋白質を用いて、20-90℃におけるアミロイド形成を調べた。多くの蛋白質は「室温(25℃)➡高温(90℃)➡室温」の操作をしたとき、アンフィンセンのドグマに従う「天然構造➡変性構造➡天然構造」の可逆的な構造変化を示した。他方、アジテーション(溶液の撹拌)を加えながら高温処理をすると、高温においてアミロイド線維を形成した。
本研究成果が社会に与える影響(本研究成果の意義)
本研究から、変性した蛋白質は過飽和状態にあり、過飽和が解消されるとアミロイド線維の形成に至ることが分かりました(図3)。
アミロイド線維の形成が、水に溶けた物質の結晶形成に似た現象であることは、長年にわたって知られていました。過飽和は結晶形成に必要不可欠です。水が氷になる反応も過飽和(過冷却とも呼ばれる)を経て起きます。別の見方をすると、過飽和がアミロイド線維形成を抑制しており、これが解消するとアミロイド線維が形成し、更にはアミロイド病の発症に至ることが示唆されました。
アミロイド病は高齢化社会の深刻な病気であり、その予防や治療は重要な研究課題です。本研究はアミロイド病の予防や治療の進展につながるとともに、蛋白質の構造と物性の理解を大きく広げるものです。
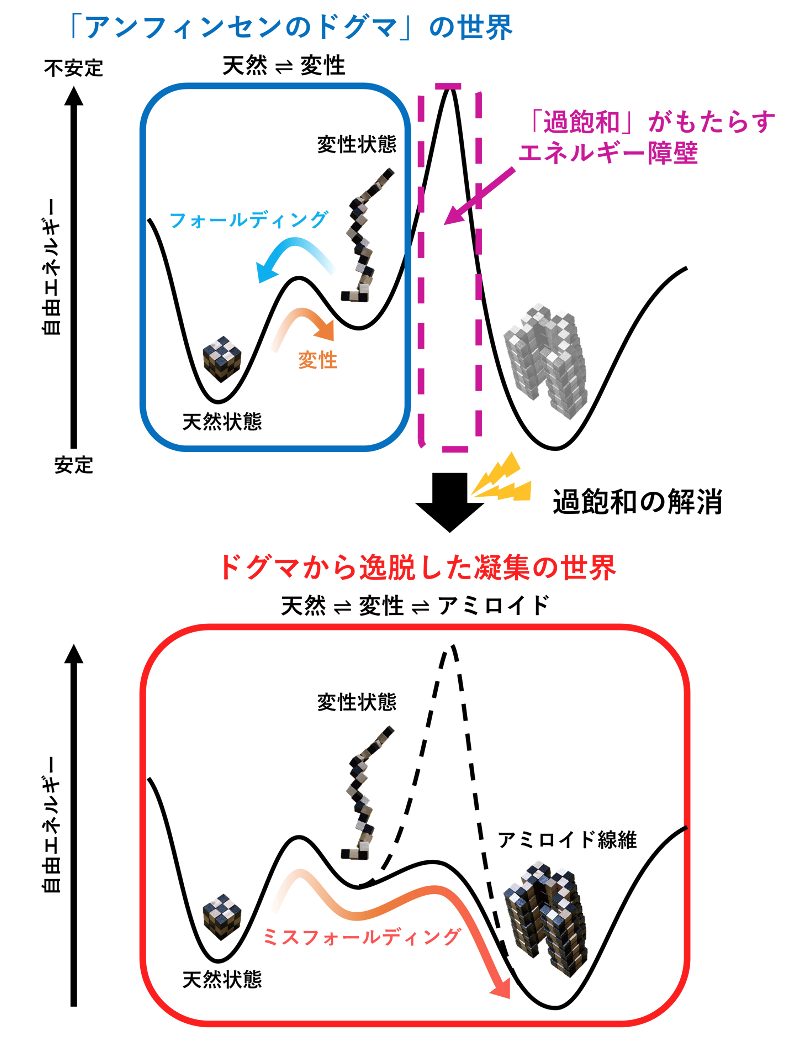
図3 フォールディング(「アンフィンセンのドグマ」の世界)とアミロイド形成(ドグマから逸脱した凝集の世界)の関係のまとめ。過飽和下でアミロイドは形成せず、過飽和はアミロイド形成を抑制している。
特記事項
本研究成果は、2021年1月26日(火)10時(英国時間)にNature Researchが提供するオープンアクセス・ジャーナルCommunications Biologyに掲載されました。
タイトル:“Breakdown of supersaturation barrier links protein folding to amyloid formation(過飽和障壁の解消が蛋白質のフォールディングとアミロイド形成を結びつける)”
著者名:Masahiro Noji, Tatsushi Samejima, Keiichi Yamaguchi, Masatomo So, Keisuke Yuzu, Eri Chatani, Yoko Akazawa-Ogawa, Yoshihisa Hagihara, Yasushi Kawata, Kensuke Ikenaka, Hideki Mochizuki, József Kardos, Daniel E. Otzen, Vittorio Bellotti, Johannes Buchner, and Yuji Goto
(野地 真広、鮫島 立志、山口 圭一、宗 正智、柚 佳祐、茶谷 絵理、赤澤 陽子、萩原 義久、河田 康志、池中 健介、望月 秀樹、József Kardos、Daniel E. Otzen、Vittorio Bellotti、Johannes Buchner、後藤 祐児)
なお、本研究は、大阪大学蛋白質研究所共同研究(CR-19-02)、同国際共同研究(ICR-16-02)、科学研究費補助金新学術領域研究(17H06352)、日本学術振興会・研究拠点形成事業(A型)、AMED先端計測分析技術・機器開発プログラムの一環として行われました。
参考URL
後藤 祐児 特任教授
研究者総覧URL http://www.dma.jim.osaka-u.ac.jp/view?l=ja&u=2495&n=%E5%BE%8C%E8%97%A4%E7%A5%90%E5%85%90&kc=1&sm=name&sl=ja&sp=1#item_kihon
ホームページURL https://mei.osaka-u.ac.jp/ https://supersaturation.sakura.ne.jp/
SDGs目標

用語説明
- アンフィンセンのドグマ
本来、アミノ酸が一次元につながった高分子鎖である蛋白質は、特異的な立体構造を形成して機能を発現します。この反応は、広がった高分子鎖が折り紙のように折りたたまれることから、「フォールディング」と呼ばれます。蛋白質は自発的にフォールディングする能力があると考えられており、このことを提唱したアンフィンセン(1972年ノーベル化学賞受賞)にちなんで「アンフィンセンのドグマ」と呼ばれます。
- アミロイド線維
変性した蛋白質が凝集すると、ゆで卵の白身のように不定形の凝集を形成すると考えられていました。ところが図1にイメージするように、規則正しく積み重なった凝集体(アミロイド線維)を形成する場合もあることがわかっています。今日、さまざまな蛋白質のアミロイド線維の原子レベルの立体構造が解明され、Protein Data Bankに登録されています。
- アミロイド病
アミロイド病(あるいはアミロイドーシス)は、アミロイド線維が組織へと沈着して発症する病気の総称であり、アルツハイマー病やパーキンソン病、透析アミロイドーシスをはじめとする多くの疾患が含まれます。アミロイド病には高齢化に伴い発症するもの(孤発性)、遺伝的な原因により若年で発症するもの(家族性)があります。透析アミロイドーシスは透析患者だけが発症するという特徴をもっています。
- 過飽和状態
結晶は、溶液中の物質の濃度が溶解度を越えたときに形成されます。しかし、物質の濃度が溶解度を越えても直ちに結晶は析出せず、このような状態を過飽和状態と呼びます。水が氷になる場合、氷点下にしてもすぐに氷ができない状況を過冷却と呼びますが、過飽和と同じ現象です。過飽和は結晶析出に必要不可欠の状態です。また、過飽和状態の溶液に既に出来上がった結晶をわずかに加えると、それを種として結晶が生成する「シーディング」が起こります。アミロイド線維の特徴もシーディングされることです。
