視神経脊髄炎の新たな病態メカニズムを発見
運動機能障害や疼痛を緩和する新規治療法の開発に期待
研究成果のポイント
- 視神経脊髄炎の炎症を制御する新たなメカニズムを解明。
- RGMaシグナルを阻害することで炎症を加速させる原因となるマクロファージを介した好中球の浸潤が抑制できることを発見。
- RGMa中和抗体の投与により、運動機能障害および疼痛症状が緩和されたことから、臨床応用につながると期待される。
概要
大阪大学大学院医学系研究科の糸数隆秀特任准教授(常勤)(創薬神経科学・分子神経科学)、山下俊英教授(分子神経科学・創薬神経科学/生命機能研究科、免疫学フロンティア研究センター兼務)、田辺三菱製薬株式会社 岩本祥佑研究員らの研究グループは、重篤な神経障害を呈する視神経脊髄炎の動物モデルを用いて、炎症を制御する新たな分子メカニズムを解明し、その分子を標的とした抗体が顕著な治療効果を示すことを明らかにしました(図1)。
視神経脊髄炎(neuromyelitis optica: NMO)は重篤な視神経炎や脊髄炎が出現する難病です。中枢神経内のアストロサイトを標的とした自己抗体によってアストロサイトが障害され、多種の免疫細胞が浸潤して高度の炎症を起こすことにより神経機能障害が生じるものと考えられていますが、その詳細なメカニズムは不明のままでした。
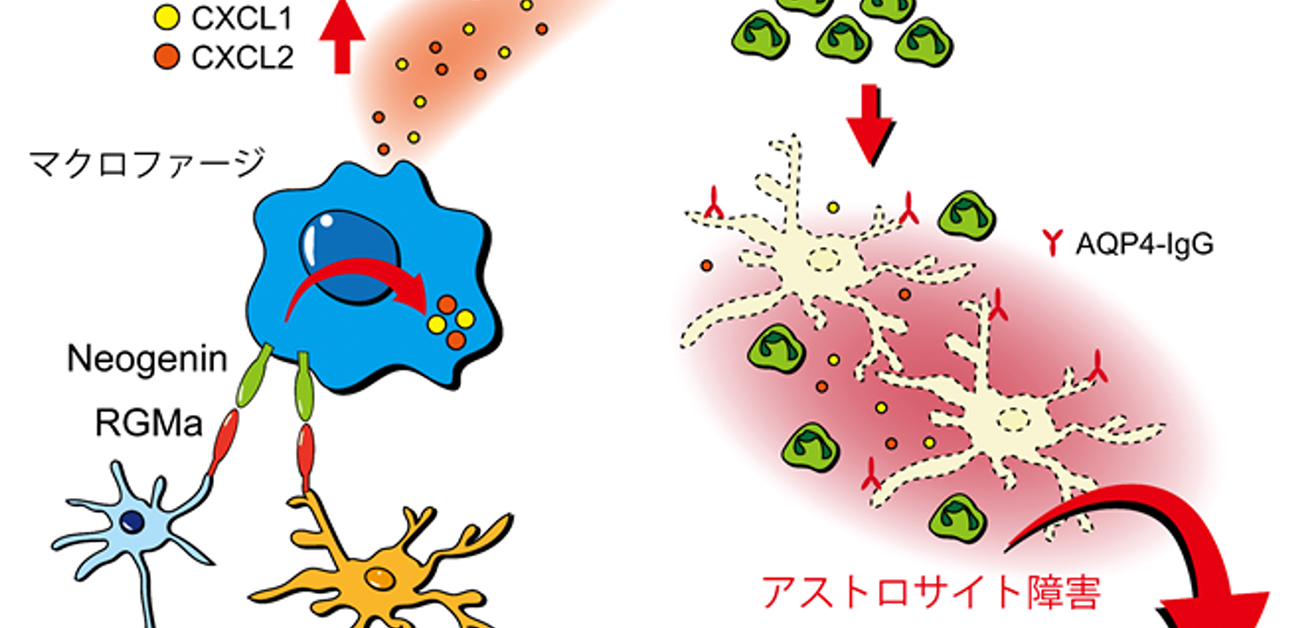
今回、研究グループは、免疫細胞の一つであるマクロファージが中枢神経系に浸潤してRGMaを介するシグナルを受け取ることで、別の免疫細胞である好中球を呼び寄せて炎症をさらに加速させている可能性を見出しました。実際に、高度の脊髄炎を呈するNMOモデルラットを用いて、RGMaの機能を阻害するRGMa中和抗体を投与して治療効果を検証したところ、好中球の浸潤が抑えられ、アストロサイト障害が緩和されること、さらに運動機能障害を大きく緩和できることが示されました。また、このモデル動物はNMO患者で大きな問題となる神経障害性疼痛を呈することを初めて明らかにしました。さらに、RGMa中和抗体の投与によって疼痛症状の遷延を顕著に抑制することができることも示しました。
本研究成果により、病初期にRGMaの機能を阻害することで、運動機能障害と疼痛の両方を緩和できる可能性が示され、既存の治療薬とは異なるメカニズムによるNMOの急性期治療薬開発の可能性が拓かれました。
本研究成果は、米国科学誌「Annals of Neurology」に、3月12日(土)午前3時(日本時間)に公開されました。
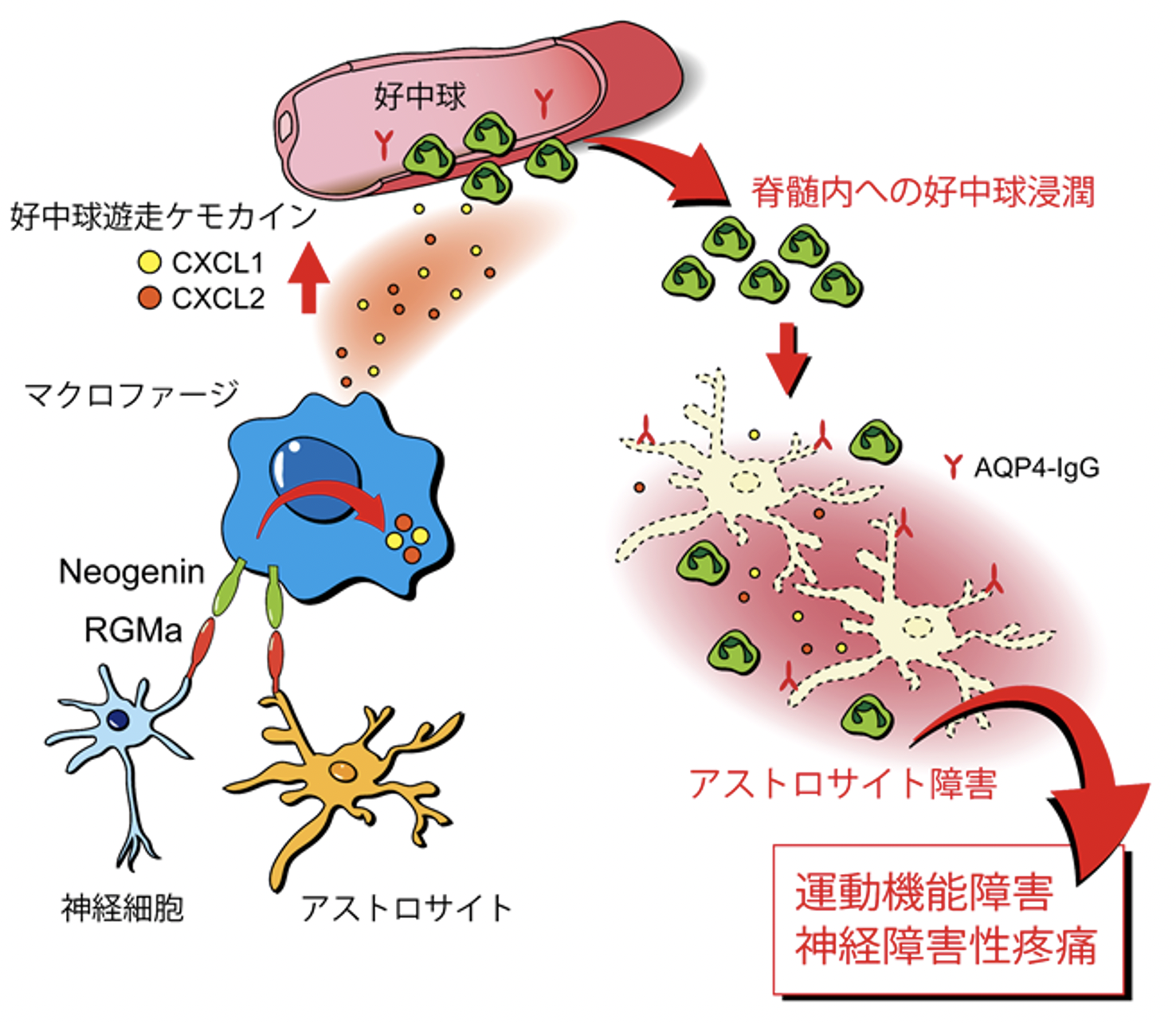
図1. 概要
研究の背景
視神経脊髄炎(NMO)は視神経炎による視力低下、および横断性脊髄炎による運動麻痺、感覚障害や疼痛などの症状をきたす中枢神経の炎症性疾患です。女性に多く、発症年齢の平均は40歳、有病率は3~4人/10万人程度とされています。視神経炎や脊髄炎は重症で、失明や歩行不能状態に至ることも稀ではありません。中枢神経内のアストロサイトを標的とした自己抗体(抗アクアポリン4(AQP4)抗体)によりアストロサイトが障害され、さらに好中球や好酸球、マクロファージなどの免疫細胞が病変部位に浸潤して重度の炎症を引き起こすことで中枢神経組織が破壊されることにより、重篤な神経症状が出現すると考えられています。NMO急性期におけるこれらの免疫細胞の浸潤を制御することができれば、病態の緩和が可能になることが期待されますが、その詳細なメカニズムは不明でした。
研究の内容
NMO急性期の詳細な病態解析のためには、実際にNMO患者で起こっている現象を反映するような動物モデルを用いることが重要ですが、既存のNMOモデル動物は病変や症状が軽微であることが弱点でした。そこで今回、共同研究先の東北大学のグループが近年開発した、高親和性抗AQP4モノクローナル抗体を用いて作製したNMOモデルラットでの検証を行いました。この動物モデルでは高度の脊髄病変と運動障害がみられることから、治療候補薬の効果を検証するのにも適していると考えられました。研究グループはこれまで、RGMaがさまざまな中枢神経疾患の病態にかかわっていることを明らかにしてきました。今回は上述のNMOモデル動物を用いて、RGMa及びその受容体であるNeogenin(ネオジェニン)に着目して研究を行いました。
NMOモデルラットの脊髄では、NMO患者と同様に、病変部位の血管から抗AQP4抗体が中枢神経内に漏れ出し、アストロサイトの障害がおこります。また、同部位において多数のマクロファージや好中球が浸潤していました。そこで詳細な組織学的解析を行い、脊髄内の神経細胞およびアストロサイトがRGMaを発現していること、さらに、浸潤してきたマクロファージがNeogeninを強く発現していることを見出しました。これらの結果は、NMO患者の病理組織を用いた検証でも確認されました。
そこでNMOモデルラットにおいて、病態を惹起した翌日に抗RGMa中和抗体を投与してRGMaの機能を阻害し、その治療効果を検証したところ、運動機能障害の増悪を抑制する効果があることが確認できました(図2)。また、NMO患者では脊髄障害に起因する慢性疼痛が高頻度にみられますが、一般に難治性であり、患者の生活の質の大きな妨げになっています。しかし、NMOモデル動物を用いた疼痛の研究はほとんど行われてきませんでした。今回研究グループはNMOモデルラットが顕著な疼痛症状を呈することを発見し、神経障害性疼痛の病態研究モデルとして有用であることを示しました。さらに、抗RGMa抗体の効果についても検証したところ、無治療群(コントロール抗体投与群)では発症後3週間後まで疼痛が持続していたのに対し、抗RGMa抗体で治療した動物においては、一旦は疼痛症状を呈するものの、速やかに疼痛症状が改善していくことが明らかになりました(図3)。
研究グループはさらにメカニズム検証を進め、マクロファージがRGMaシグナルを受け取ることでCXCL2などのケモカインを過剰に産生するようになることを見出しました(図4)。また、抗RGMa抗体で治療した動物では、病変部のマクロファージの数には大きな変化がない一方で、ケモカインの産生、および好中球の浸潤が著明に抑制され(図5)、アストロサイト障害も緩和されていることを明らかにしました。
以上の結果から、中枢神経内に浸潤したマクロファージがRGMaを介したシグナルを受け取ることでケモカインを過剰に産生して好中球を呼び寄せ、神経炎症をさらに増悪させている可能性が示唆されました。
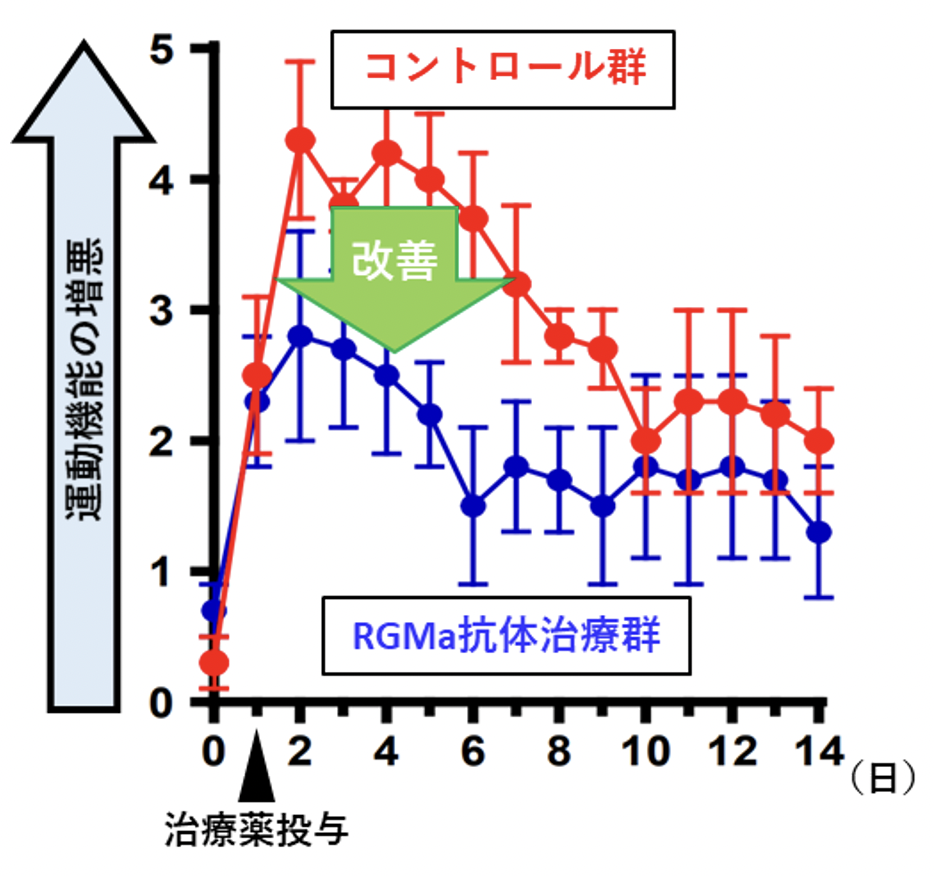
図2. 神経スコア
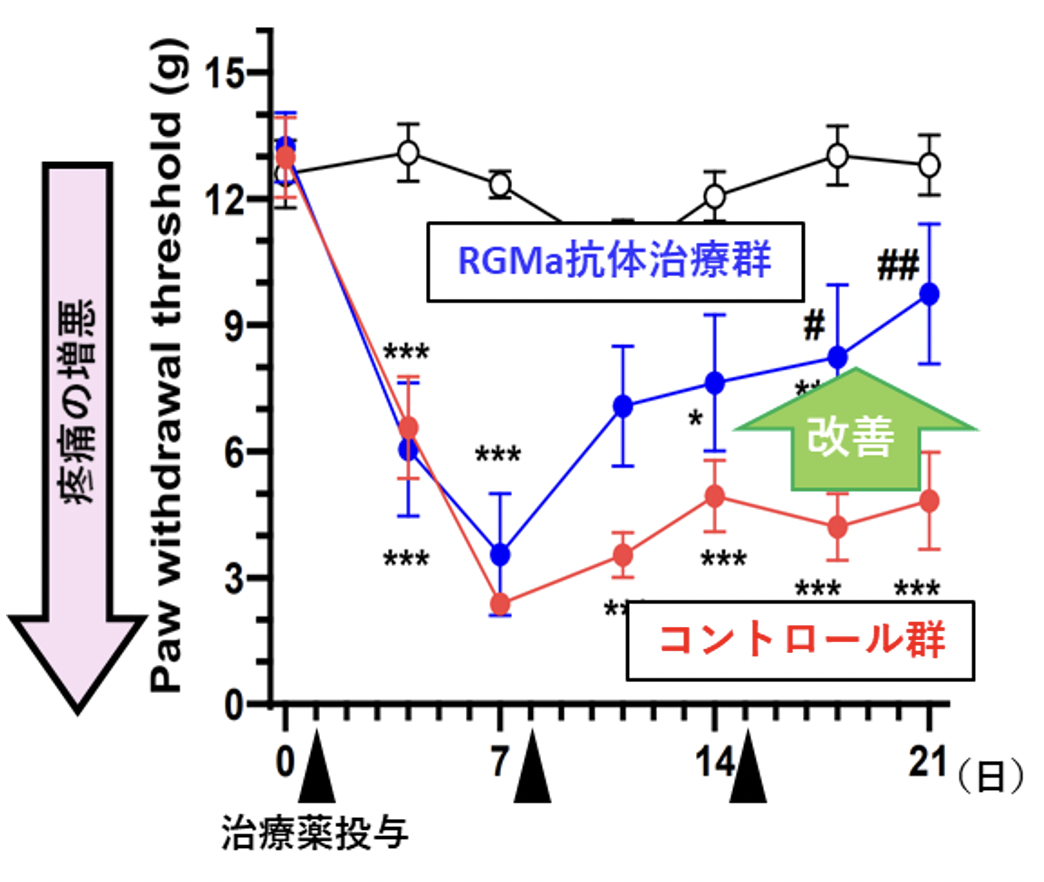
図3. 疼痛閾値
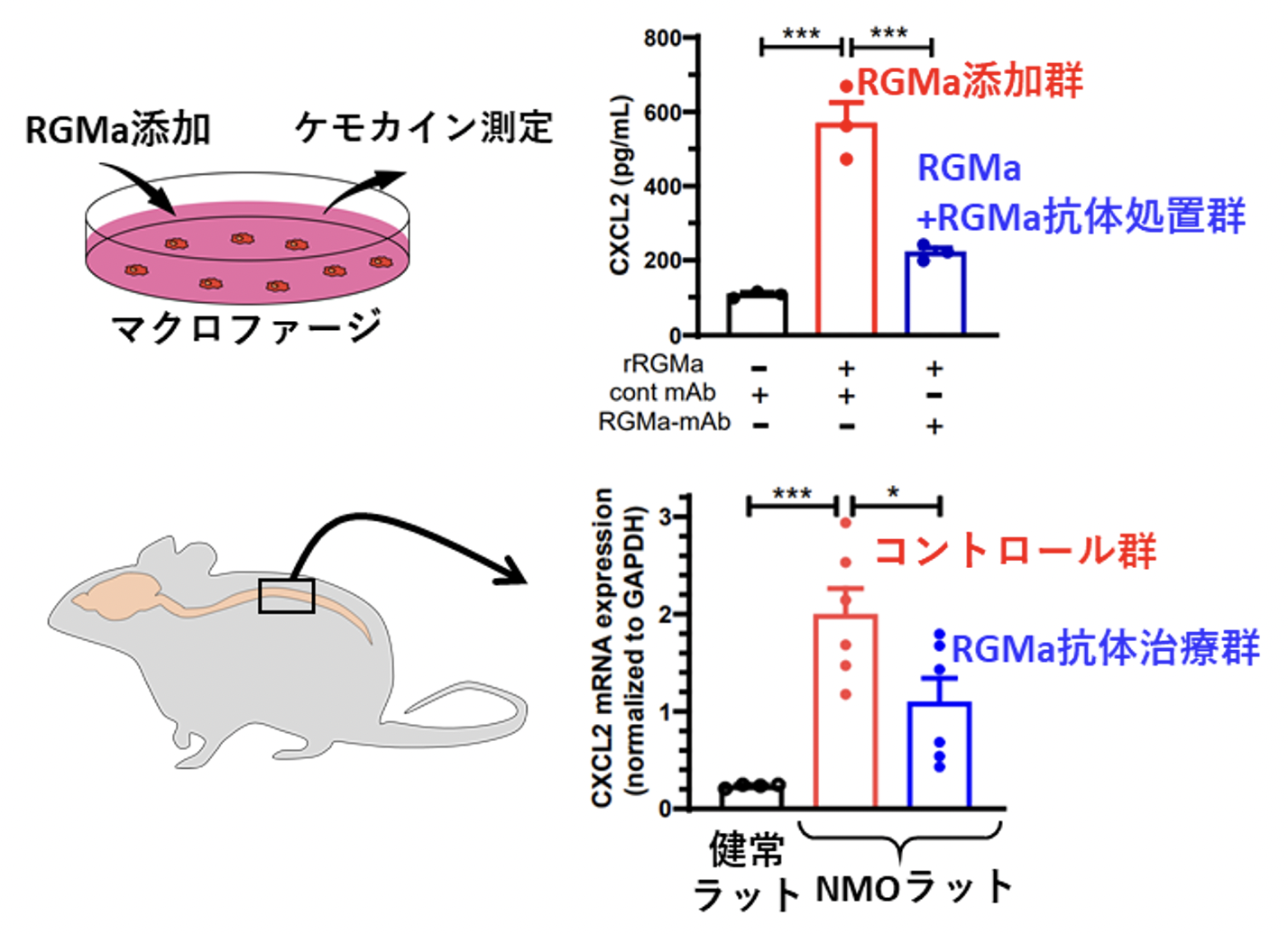
図4. RGMaによるケモカイン産生誘導
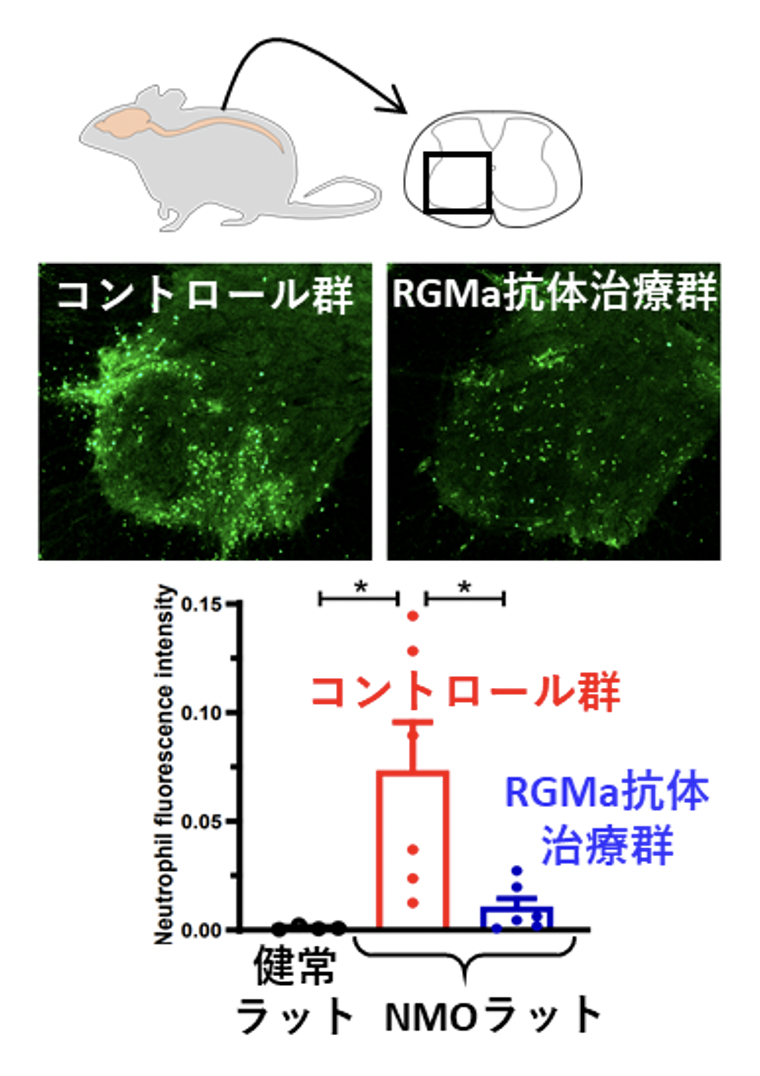
図5. RGMa抗体による好中球浸潤抑制
本研究成果が社会に与える影響(本研究成果の意義)
本研究成果により、視神経脊髄炎の炎症を制御するRGMaを介した新規メカニズムが明らかになり、抗RGMa抗体が運動障害のみならず疼痛の緩和にも有効である可能性が示されました。また、今回明らかになったマクロファージと好中球の連関はさまざまな神経疾患における神経炎症病態に共通している可能性が高く、今後、幅広い神経疾患に対して抗RGMa抗体投与が有効な治療法となることが期待されます。
特記事項
本研究成果は、2022年3月12日(土)午前3時(日本時間)に米国科学誌「Annals of Neurology」に掲載されます。
論文タイトル: RGMa signal in Macrophages Induces Neutrophil-related Astrocytopathy in NMO
著者: Shosuke Iwamoto, Takahide Itokazu†, Atsushi Sasaki, Hirotoshi Kataoka, Shinji Tanaka, Takeshi Hirata, Keiko Miwa, Toshihiko Suenaga, Yoshiki Takai, Tatsuro Misu, Kazuo Fujihara, Toshihide Yamashita† (†責任著者)
なお、本研究は、日本医療研究開発機構(AMED)の革新的先端研究開発支援事業(AMED-CREST)「生体組織の適応・修復機構の時空間的解析による生命現象の理解と医療技術シーズの創出」研究開発領域における研究開発課題「神経—生体システム連関のレジリエンス機能の統合的解明」(研究開発代表者:山下俊英)の支援を受けて行われ、東北大学大学院医学系研究科 藤原一男教授らの協力を得て行われました。
参考URL
用語説明
- RGMa
Repulsive guidance molecule a。軸索再生阻害因子の一つとして発見され、本タンパク質の機能を阻害することで損傷した神経線維が伸長し機能回復に寄与することが脊髄損傷の動物モデルから示されている。他にもT細胞の免疫応答の制御など、多彩な機能を持つことが明らかになりつつある。
- アストロサイト
中枢神経に存在するグリア細胞の一つで、神経細胞の機能や代謝のサポートを担い、また血液脳関門の主要な構成要素となるなど、中枢神経系の恒常性の維持に重要な役割を果たしている。
- 高親和性抗AQP4モノクローナル抗体
AQP4は主にアストロサイトの足突起の膜上に発現するタンパク質で、細胞への水の取り込みに関与する水チャネルの一つであり、NMOではAQP4に結合する自己抗体(抗AQP4抗体)が病原性をしめす。本研究では、実際のNMOにより近い動物モデルを開発するために作製された、AQP4に高い親和性をもつ抗体を用いた。
- ケモカイン
細胞の遊走を促進する機能を持つサイトカインの一群。障害部位で産生され、血管内から白血球を誘導することで炎症の形成に関与する。特にCXCL2やCXCL1は強力な好中球遊走促進作用をもち、多発性硬化症や脳血管障害などの中枢神経系の炎症病態にも深くかかわっていると考えられている。
