骨形成に必須の転写因子Runx2による ゲノムDNAの制御機構が明らかに
DNA設計図に基づく骨の発生機構の理解に向けて
研究成果のポイント
- 骨組織を構成する骨芽細胞と軟骨細胞の発生過程において遺伝子発現を制御する仕組みの解明に取り組みました。
- 骨の発生に必須な転写因子として知られるRunx2が、ゲノムDNAの構造を制御することで、骨格系細胞の運命決定を担うことを明らかにしました。
- 本研究を通してDNA設計図から骨発生機構の一端を理解することが可能になりました。今後、骨の再生医療や、骨の病気の治療法の確立に役立つことが期待されます。
概要
大阪大学大学院歯学研究科口腔分化発育情報学講座の大庭伸介教授(研究当時:東京大学大学院医学系研究科附属疾患生命工学センター准教授、長崎大学生命医科学域(歯学系)教授)、東京大学大学院医学系研究科附属疾患生命工学センターの北條宏徳准教授、鄭雄一教授、米国南カリフォルニア大学のアンドリュー・マクマホン教授をはじめとする国際共同研究グループは、骨組織を構成する主要な細胞である骨芽細胞と軟骨細胞の発生機構の一端を解明しました。
骨の発生には遺伝子発現を制御するタンパク質Runx2が必要であることが以前から分かっていましたが、Runx2がゲノムDNAのどこに・どのように作用するのか、その制御機構は十分に分かっていませんでした。本研究グループは、次世代シークエンサー解析、マウス遺伝学に加えて、ゲノム編集技術と一細胞解析を融合した最新の解析技術を駆使することで、Runx2を介する骨芽細胞と軟骨細胞の遺伝子発現機構の一端を明らかにしました。本結果は、骨発生メカニズムの理解と新たな骨再生戦略の確立へと発展することが期待されます。
本研究成果は、2022年9月6日(米国東部時間)に米国科学誌「Cell Reports」のオンライン版に掲載されました。
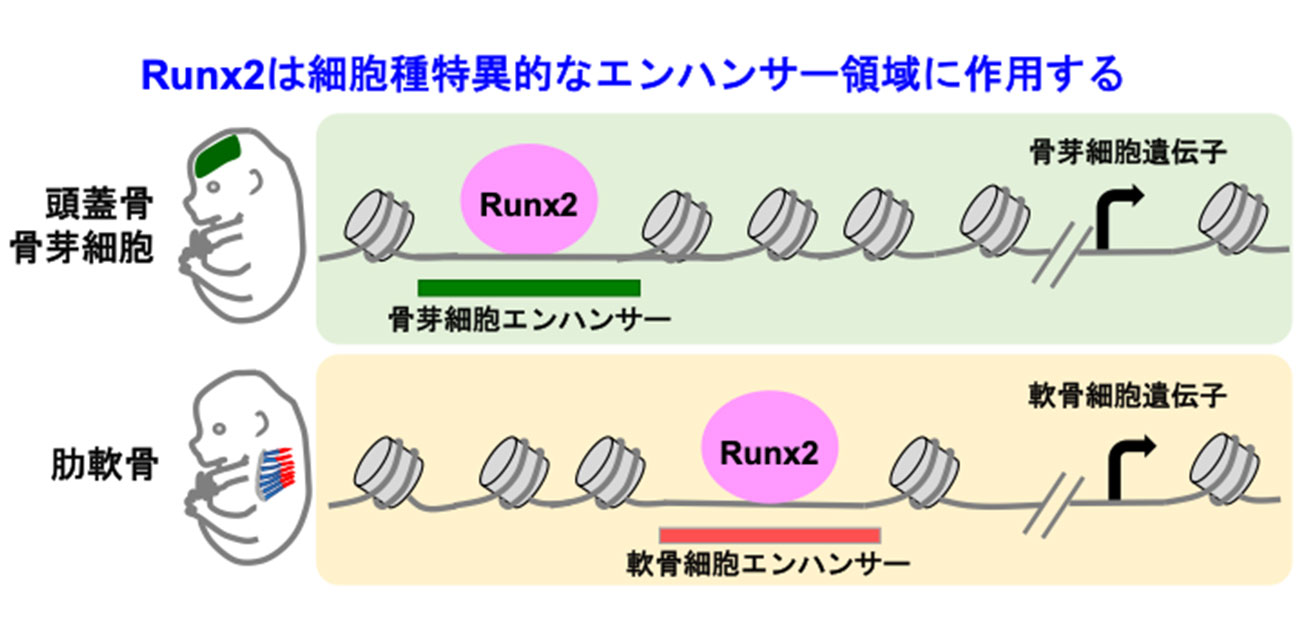
図. 本研究で明らかになったRunx2を介した骨発生機構
骨を形成する主要な細胞である骨芽細胞と軟骨細胞において、Runx2は異なるゲノムDNA領域に作用し、細胞種特異的なエンハンサーを形成する。また、Runx2はオープンクロマチン形成に必要である。
研究の背景
「生命の設計図」と呼ばれるゲノムDNAには、タンパク質をコードする遺伝子に加えて、遺伝子の活性(転写)を制御するエンハンサー領域が存在します。異なる臓器・組織を構成する細胞が、同一のゲノムDNA配列を有しているにも関わらず、それぞれの臓器・組織で固有の形態・特性・はたらきをするのは、細胞により異なるエンハンサー群・遺伝子群が活性化しているためです。しかし、身体を構成するそれぞれの細胞が、どのような遺伝子群を発現しているのか、その遺伝子群を制御するエンハンサー領域がゲノム上のどこにあり、どのように活性化されているのか、そのメカニズムは十分に分かっていません。
骨組織は身体の支持組織として、またミネラル貯蔵の場・造血の場として重要なはたらきをします。骨の発生は胎生期から成長期にかけてダイナミックに進行します。身体を構成する大部分の骨は、内軟骨性骨化と呼ばれる発生機構により形成されます。ここでは骨格系前駆細胞から、軟骨細胞の増殖・分化(成熟化)と骨を形成する骨芽細胞の運命決定・分化が共役して起こります。転写因子Runx2は骨発生に必須であり、軟骨細胞の成熟化と骨芽細胞の運命決定を制御するタンパク質です。Runx2はDNAに結合して、特定の遺伝子を活性化させることがわかっています。しかし、Runx2が軟骨細胞と骨芽細胞のゲノム上で、どこで・どのようにはたらいているか、その転写制御のメカニズムは十分に明らかになっておりませんでした。
研究の内容
本研究グループは、次世代シークエンサーを駆使したゲノムワイド解析を通して、骨発生における軟骨細胞と骨芽細胞のエンハンサー領域の全貌と、Runx2が制御する転写機構の解明に取り組みました。Runx2が結合するゲノムDNA領域を網羅的に同定するため、3xFLAGを含むエピトープタグをRunx2遺伝子座にノックインしたマウスを作製し、抗FLAG抗体を用いたクロマチン免疫沈降法シークエンシング法を行いました。また、活性化エンハンサー領域では、オープンクロマチン領域と呼ばれる、ゲノムDNAとヒストンタンパク質への結合がほどけた特徴的な構造を取っていることが知られています。そのため、骨芽細胞や軟骨細胞でエンハンサー候補領域を同定するため、オープンクロマチン領域を検出するATAC-seq解析を行いました。その結果、Runx2は骨芽細胞と軟骨細胞で細胞特異的なオープンクロマチン領域に集積していることが分かりました。バイオインフォマティクス解析により、このオープンクロマチン領域には、Runx2と共に細胞特異的な転写因子群や、両細胞で共通する転写因子群が一緒にはたらくことで、オープンクロマチン領域を制御している可能性が示唆されました。
次に、Runx2がオープンクロマチン領域の形成に必要かどうか検証するため、マウス発生工学を駆使することで、骨形成に寄与する細胞集団でのみRunx2遺伝子の欠損と蛍光タンパク質tdTomatoの標識を行い、Runx2遺伝子欠損細胞を単離した後、ATAC-seq解析を行いました。その結果、Runx2を欠損させると、骨芽細胞で重要だと考えられるエンハンサー領域の多くでDNA構造が変化し、転写因子群が作用することが困難になる可能性が示されました。一方、培養線維芽細胞にRunx2を異所性に発現させると、Runx2によるエンハンサー領域のDNA構造変化を介して骨芽細胞へ運命決定されることも確認できました。
最後に、同定したRunx2依存的なエンハンサー候補領域の中で、骨形成への寄与が高いエンハンサーを同定するため、ゲノム編集技術と一細胞RNA-seq解析を統合することで、エンハンサー領域の欠損とそれに伴う遺伝子変化を同時に検出可能な実験系を立ち上げました。本実験系を用いて、エンハンサー候補領域をスクリーニングしたところ、骨発生に重要な転写制御因子であるSp7の転写開始点から11 kb離れた遠位エンハンサーを同定しました。マウス発生工学技術を用いて、同定したエンハンサーの転写活性をマウスの全身で検討したところ、骨組織中の骨芽細胞特異的に活性化することを確認しました。さらに本エンハンサーを欠損したノックアウトマウスを作出し、骨組織を解析したところ、骨量の有意な抑制が認められました。
本研究成果が社会に与える影響(本研究成果の意義)
本研究は、骨発生においてRunx2がゲノムDNAに作用するエンハンサー領域を網羅的に明らかにしました。一連のデータは公共データベースへ登録されております。さらにRunx2がゲノム構造の変化に寄与することを世界で初めて明らかにしました。以上の結果は、ゲノムDNAから骨組織を形成する細胞の発生の設計図を理解し、今後、骨再生や骨疾患の治療に役立つ成果であると考えられます。
特記事項
本研究成果は、2022年9月6日(火)(米国東部時間)に米国科学誌「Cell Reports」(オンライン)に掲載されました。
タイトル:“Runx2 regulates chromatin accessibility to direct the osteoblast program at neonatal stages”
著者名:Hironori Hojo*, Taku Saito, Xinjun He, Qiuyu Guo, Shoko Onodera, Toshifumi Azuma, Michinori Koebis, Kazuki Nakao, Atsu Aiba, Masahide Seki, Yutaka Suzuki, Hiroyuki Okada, Sakae Tanaka, Ung-il Chung, Andrew P. McMahon, and Shinsuke Ohba*
なお、本研究は、主に科研費「若手研究(A)(課題番号:17H05106)」、「基盤(B)(課題番号:20H03885)」、「基盤(B)(課題番号:17 H04403)」、「挑戦的研究(萌芽)(課題番号:21K19589)」、「先進ゲノム支援 (PAGS) (課題番号:16H06279)」、AMED「再生医療実現拠点ネットワークプログラム(課題番号:JP21bm0704071)」の支援により実施されました。
参考URL
用語説明
- エンハンサー
ゲノムDNAの中で、遺伝子の転写量を増加させる作用を有する領域。遺伝子開始点近傍に存在するプロモーターと呼ばれる領域と相互作用することで、標的とする遺伝子に作用する。プロモーター領域からの距離や位置、方向に関係なくはたらくと考えられている。
- 転写因子Runx2
ゲノムDNAのプロモーター領域やエンハンサー領域に結合して、標的とする遺伝子の転写量の調節にはたらくタンパク質を転写因子と呼ぶ。Runx2は、Runt-related transcription factor 2の略語で、RUNT領域を有する転写因子の一つ。遺伝子改変マウスを用いた解析により、Runx2遺伝子がないと骨発生が起こらないことから、骨のマスター転写因子と呼ばれている。
- クロマチン免疫沈降法シークエンシング法
目的とするタンパク質が結合しているDNA領域をゲノム全域で探索的・網羅的に解析できる手法。細胞内の蛋白質とDNAの結合を架橋固定により保存したのちに断片化し、目的とする蛋白質に対する抗体を用いた免疫沈降により蛋白質-DNA複合体を精製する。精製物中のDNAの配列を次世代型シークエンサーで解析し、得られた配列データをゲノム配列と比較する。取得した配列が多い領域が結合領域として検出される。
- ATAC-seq解析
Assay for Transposase-Accessible Chromatin-シークエンシング法の略語。Tn5 トランスポゼースを用いてオープンクロマチン領域の断片化と特異的DNA配列を付加することで、次世代シークエンサー用のDNAライブラリーを構築可能。これにより、ゲノム全域でオープンクロマチン構造を選択的に検出することが可能になる。
