膵がんの転移をくい止める!
膵がんが全身へ広がっていく新たな仕組みを発見
研究成果のポイント
- これまで知られていなかった膵がん細胞が全身の臓器へ広がる仕組みを発見し、それを評価できる実験方法を確立
- 膵がん細胞にピンポイントに集まり転移を抑える治療薬を開発し、マウス実験によって、良好な結果を得た
- 今回開発した治療薬はピンポイントにがん細胞に集まることから、副作用の少ない治療薬となる可能性が期待される
概要
大阪大学大学院医学系研究科の大学院生の原田昭和さん(博士課程)と菊池章教授(分子病態生化学)らの研究グループは、膵がんが全身へ広がっていく新たな仕組みを解明しました。さらに、膵がん細胞を特異的に攻撃し、転移を抑える治療薬を開発し、マウスを用いた実験にて、転移が抑えられることを明らかにしました。
膵がんは転移する頻度が高いことが知られています。転移する際、血管やリンパ管といった全身をめぐる流れにのる必要がありますが、膵がんの場合、周りの線維性の組織(間質)が非常に多いことが知られています。転移するためにはこの間質を壊しながら進む(浸潤する)必要があります。ところが、一部の膵がん細胞ではどのように転移・浸潤するのかその仕組みがよく分かっておらず、治療薬の開発を妨げていました。
今回研究グループは、膵がんで強く発現しているArl4c(ADP-ribosylation factor -like 4c)に注目し、転移・浸潤の新たな仕組みを解明することに成功しました。これまで、膵がん細胞が浸潤する際、invadopodia(浸潤突起)と呼ばれる構造を使って細胞のすぐ下の組織を壊していると考えられていました。ところが、本研究によって、Arl4cを多く発現する膵がん細胞では、invasive pseudopod(浸潤仮足)と呼ばれる長い突起構造を作ることがわかりました(図1a)。Arl4cはその突起の先端に位置し、がんのまわりの組織を破壊するのに必要なタンパク質(IQGAP1やMMP14)を呼び集める重要な働きがあることがわかりました(図1b)。
さらに、このArl4cを標的とした、アンチセンス核酸とよばれる治療薬を開発し、マウスを用いた実験で転移が抑えられることを明らかにしました。今後、膵がん細胞を特異的に攻撃することから、副作用の少ない治療薬として治療現場への応用も期待されます。
本研究成果は、オープンアクセス誌「eLife」に、2021年9月30日(米国時間)に公開されました。
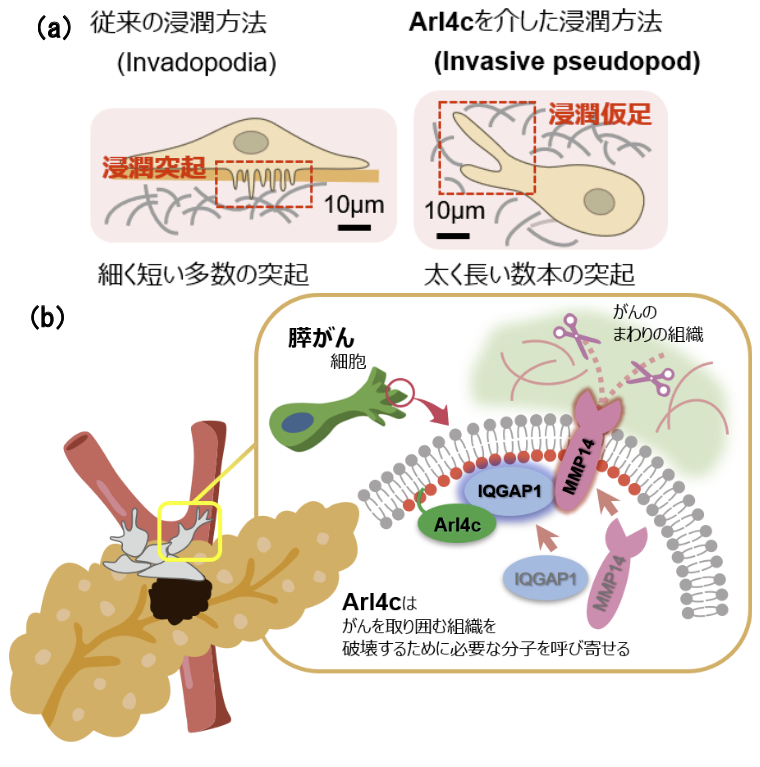
図1. Arl4cを介して膵がんが転移・浸潤する仕組み
(a) 従来の浸潤方法とArl4cを介した方法は異なる
(b) Arl4cを介した転移のメカニズム
研究の背景
様々ながんで治療法の開発が進む中、膵がんは依然として死亡率が高いことが知られています。その主な理由は発見された時にはすでに転移がみられ手術ができない場合が多いからです。死亡する原因で最も多いのは、この転移によるものです。
ただ現時点では、転移を抑える有効な治療薬はありません。転移の仕組みに関するこれまでの知見をもとに、世界中の研究者たちが治療薬の開発を進めていますが、転移の仕組みがはっきり分からないタイプの存在が知られています。このために有効な治療薬開発に結びつかないものと思われます。
本研究の成果
がんは、がん自身の独自のシステムを使って進行する場合もありますが、もともと私たちの体内に備わっているシステムを暴走させることで凶悪化することがあります。そこで、研究グループは、正常のシステムのうち、特に強い力を発揮しうるものとして臓器を形作るメカニズムに注目しました。そのなかで、タンパク質Arl4cは細胞の形を変え、運動能を高めることで、臓器を形作る駆動力の源になります。このArl4cの発現量を大きく増やす仕組みが、実は膵がんで異常に亢進していることが分かりました。
さらに、大阪大学大学院医学系研究科消化器外科学との共同研究により、実際の患者さんの膵がんの検体を調べたところ、Arl4cが非常に高く発現している患者さんは、特にがんが周りの組織へ広がりやすい特徴をもつことが分かりました。そこで、Arl4cをもつ細胞がどのように組織の中を突き進んで広がるのか、簡単にモニタリングできる実験方法を確立しました。その結果、Arl4cを高く発現する細胞では、従来とは異なる方法で周りの組織を壊しながら進んでいくことがわかりました(図2)。つまりArl4cは膵がんの凶悪化の原因になります。
そしてこのArl4cを標的としたアンチセンス核酸とよばれる治療薬を開発しました。マウスを用いた実験では、転移する前の膵がんマウスにこの治療薬を投与すると、転移が強く抑えられました。また治療薬が膵臓のがん部分にピンポイントに集まることもわかりました。
Arl4cが転移の仕組みの新たな基盤となり、治療薬開発の可能性を秘めていることが証明されました。

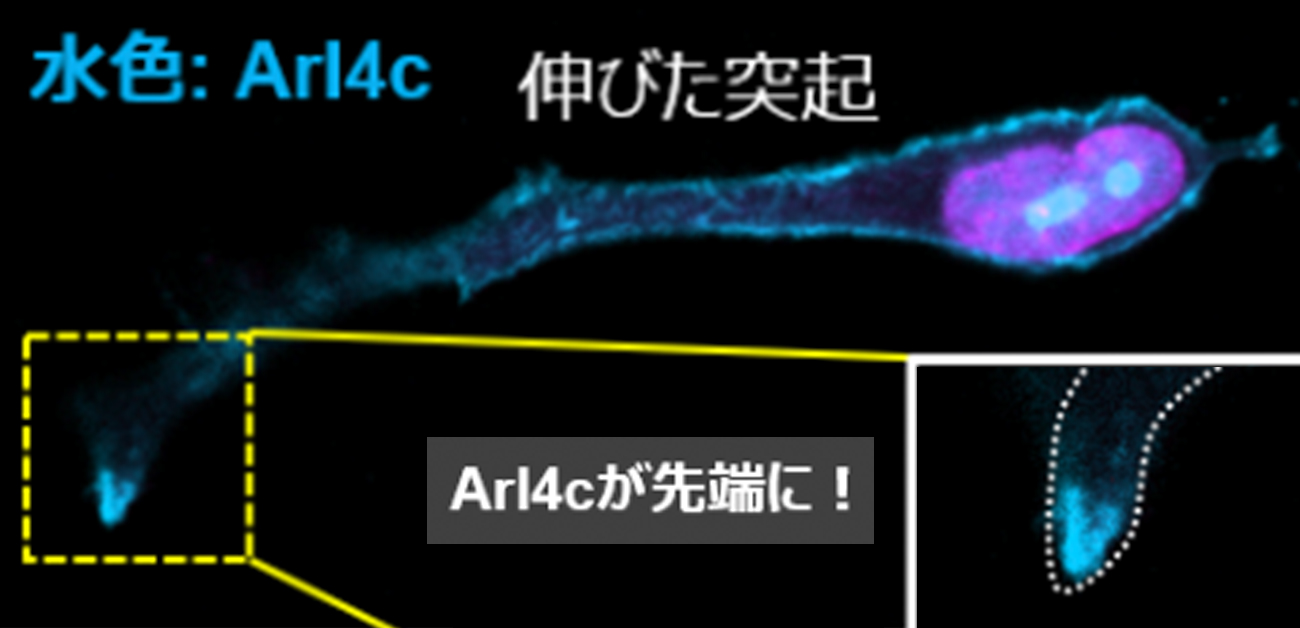
図2. Arl4cが膵がんの転移を促す
(A) 細胞の先端にArl4cが集まっている
(B) Arl4cのまわりでコラーゲンの分解が起きている
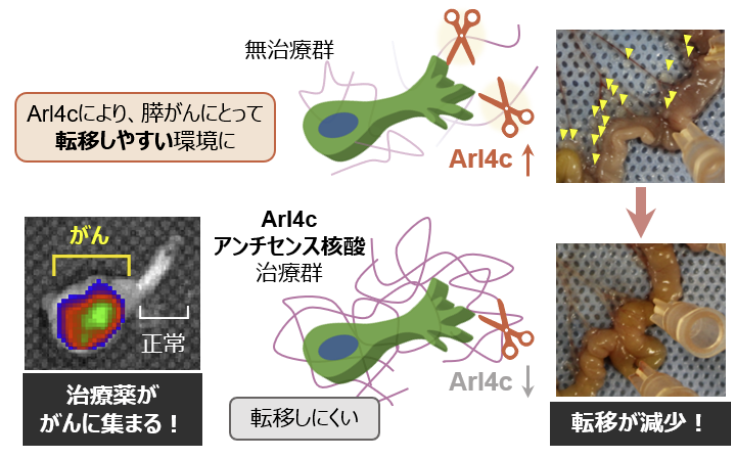
図3. 膵がんの新しい治療戦略
Arl4cを標的としたアンチセンス核酸により、Arl4cを抑えることで、転移が減少した
本研究成果が社会に与える影響(本研究成果の意義)
Arl4cは胎児のころには腎臓等の臓器に発現していますが、生後はその発現は低く、その機能はよくわかっていません。ところが、がんが発生すると、がん部分でのみ特異的に強く発現します。つまりArl4cを抑える治療薬を投与しても、正常の臓器に悪影響を及ぼす可能性が低いと思われます。さらに、今回開発したアンチセンス核酸はピンポイントにがん細胞に集まることから、副作用の少ない治療薬となることが期待され、社会的な意義が大きいと考えます。
また膵がんの新たな転移の仕組みを解明し、それを評価できる実験方法も確立したことから、今後転移の研究が進展するものと思われます。
特記事項
本研究成果は、2021年9月30日(米国時間)にオープンアクセス誌「eLife」(オンライン)に掲載されました。
【タイトル】 “Localization of KRAS downstream target ARL4C to invasive pseudopods accelerates pancreatic cancer cell invasion”
【著者名】 Akikazu Harada1,4, Shinji Matsumoto1,4, Yoshiaki Yasumizu3,4, Kensaku Shojima1,5, Toshiyuki Akama1, Hidetoshi Eguchi2, and Akira Kikuchi1,4
【所属】
1. 大阪大学 大学院医学系研究科 分子病態生化学
2. 大阪大学 大学院医学系研究科 消化器外科学
3. 大阪大学 免疫学フロンティア研究センター 実験免疫学
4. 大阪大学 先導的学際研究機構 生命医科学融合フロンティア研究部門
5. ソーク研究所 遺伝子発現研究室
【DOI】 10.7554/eLife.66721
なお、本研究は、文部科学省科学研究費補助金事業の一環として行われ、大阪大学 大学院医学系研究科 消化器外科学 江口英利教授の協力を得て行われました。
参考URL
用語説明
- 転移
がんが周りの組織や臓器に広がっていくことをいいます。遠くへ転移するためには血管やリンパ管といった全身をめぐる流れにのる必要がありますが、まずはそこまでがん細胞がたどり着く必要があります。膵がんの場合、周りの線維性の組織(間質と呼ばれます)が非常に多いことが知られています。転移するためにはこの間質を壊しながら進む(浸潤と呼ばれます)必要があります。
- アンチセンス核酸
タンパク質を合成するための設計図であるmRNA(メッセンジャーRNA)を分解する分子のことです。この分子に特殊な修飾を付け加える(本研究で用いた修飾型アンチセンス核酸)ことで、血液中で安定に存在することができ、治療効果が高まります。さらにアンチセンス核酸で問題となる肝臓に対する毒性を低く抑えることが可能になりました。
