相互反発分子によって脳の配線はスッキリつながる
大脳皮質が機能領野ごとに区分され接続する仕組みを解明
研究成果のポイント
大脳皮質には様々な領野があり、機能ごとに区分されているが、それぞれの神経回路が混線することなく、脳の離れた領域につながる仕組みは不明であった
細胞膜タンパク質であり、結合すると両方向に反発性のシグナルが伝わる相互反発分子EphA7(エフエー7)とEfnA5(エフリンエー5)が脳領域ごとに区分された神経回路形成を制御することを発見
神経回路形成異常を一因とする疾患(群)の理解や脳内回路再生による治療法開発への応用に期待
概要
大阪大学大学院医学系研究科の猪口徳一助教(神経機能形態学)(研究当時[現:福井医療大学])、連合小児発達学研究科の佐藤真教授(医学系研究科 神経機能形態学(兼任))らの研究グループは、大脳と小脳を連動させるのに重要な中継場所である、橋(きょう)へ大脳皮質から伸びる神経回路(皮質橋路)がつくられる過程で、大脳皮質の機能領野ごとに神経回路を区分して接続する仕組みを明らかにしました。
大脳皮質は、運動や体性感覚など、機能によって異なるさまざまな領野(機能領野)があり、それぞれの神経細胞から伸びた軸索は、由来する皮質領野に対応した橋核の特定の領域へ回路を接続することが知られていました。しかしながら、脳の離れた領域を結ぶ神経回路が混線すること無く正確に区分されて標的脳領域につながる仕組みはよくわかっていませんでした。
今回、研究グループは、神経細胞の細胞膜に存在し、相互に反発する分子であるEphA7とEfnA5が、大脳皮質と橋核の両方で領域特異的かつ相互排他的に発現していることに着目しました。EphA7とEfnA5は、それぞれ受容体とそれに結合するリガンドで、隣り合った細胞にそれぞれの分子が発現し、結合した場合は、それぞれの分子を介して両方の細胞内に反発性のシグナルが伝達され、細胞は互いに離れるように働くことが知られています。ストライプ状に相互反発分子をプリントした基質上で、大脳皮質全長スライスを培養する手法や、マウス胎児脳内での遺伝子操作技術を用いて、皮質橋路の回路形成における EphA7とEfnA5の機能解析を行いました。その結果、これら分子の相互反発作用が、大脳皮質と橋核それぞれにおける機能領域の区分化を制御するとともに、区分化された領域同士の接続を制御し、正確な回路形成を可能にしていることがわかりました(図1)。
これにより、脳の配線である神経回路の不要な混線を防ぎ正確につなぐ仕組みの理解や、神経回路形成異常を一因とする疾患(群)の病態解明や脳梗塞後の新たな機能回復法の開発につながることが期待されます。
本研究成果は、米国科学誌「The Journal of Neuroscience」に6月3日(木)午前6時(日本時間)[6月2日(水)午後5時(米国東部時間)]に掲載されました。
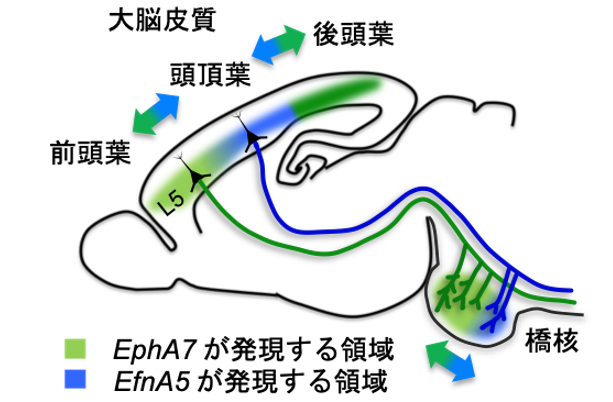
図1. EphA7とEfnA5による脳領域ごとに区分された神経回路形成の制御メカニズム EphA7(緑)とEfnA5(青)は、大脳皮質とその投射先である橋核で相互排他的に発現することで、神経回路が混線することなく区分された脳領域同士の接続を制御している
研究の背景
脳が正常に働くためには、神経回路が情報の種類や質によって区分され、適切な相手と接続する必要があります。大脳から小脳への出力回路である皮質橋路は、大脳皮質から脊髄へと伸びる軸索の束(後の皮質脊髄路)の途中から枝分かれした軸索側枝が橋核へつながることで回路がつくられます。このとき、運動野・体性感覚野・視覚野など、由来する皮質領野に対応した橋核内の特定の領域へと軸索側枝が投射し、回路を接続することが知られていました。しかし、このように神経回路が他の領域に入り込むこと無く目的の相手とスッキリと接続する仕組みはよくわかっていませんでした。
本研究の成果
研究グループは、神経回路が形成される時期のマウス大脳皮質において、EphA7が前頭葉(運動野のある領域)と後頭葉(視覚野のある領域)に、EfnA5が頭頂葉(体性感覚野のある領域)に相互排他的に発現していること、さらに大脳から小脳への出力回路の接続先である橋核においても、これら分子が相互排他的に発現していることを発見しました。そして、神経回路を可視化する色素トレーサーを大脳皮質の各領域に注入して橋核でのつながり方を調べると、反発作用を持つ結合相手の発現する領域を避け、同じ分子を発現している領域同士がつながっていることがわかりました(図2)。
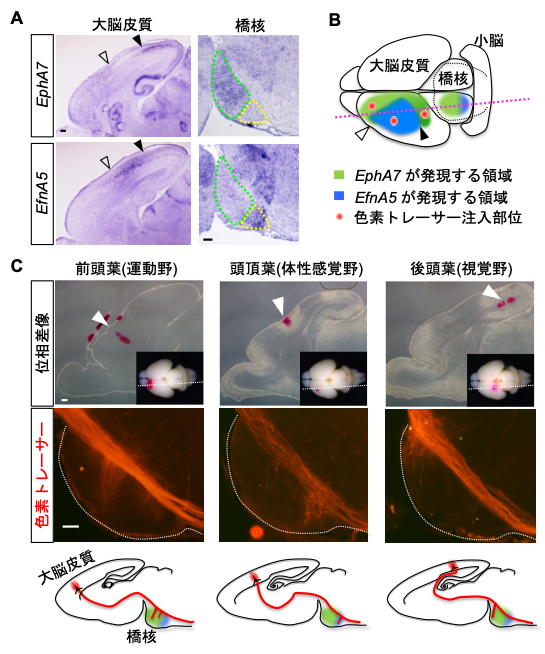
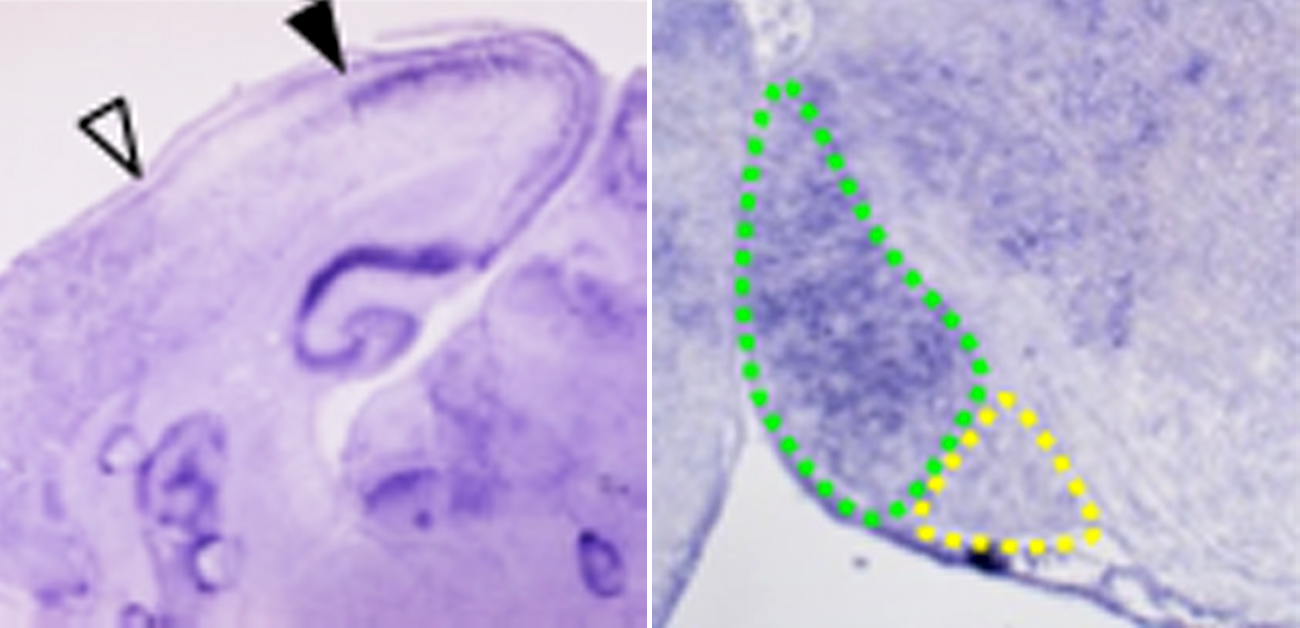
図2. EphA7とEfnA5の脳での発現パターンと投射様式の関係
(A)EphA7とEfnA5は皮質橋路の起始細胞が存在する大脳皮質とその投射先である橋核で相互排他的に発現していた(矢頭はEphA7とEfnA5発現領域の境界を示す)。
(B)EphA7とEfnA5の発現領域および(C)における色素トレーサー注入部位の模式図。破線は(A),(C)で観察している切断面を示す。
(C)色素トレーサーを注入して神経回路の投射様式を調べた(矢頭はトレーサー注入部を示す)。EphA7が発現する前頭葉・後頭葉からは橋核の吻側(前)領域に軸索側枝が投射し、EfnA5が発現する後頭葉からは橋核の尾側(後)領域に軸索側枝が投射していた。
続いて、ストライプ状にEfnA5をプリントした基質上で、大脳皮質の全長スライスを培養する手法を独自に確立し、大脳皮質の各領域から伸びる軸索の反応を調べました。すると、EphA7が発現している前頭葉と後頭葉から伸びた軸索はEfnA5をプリントした領域を避けて伸び、一方、EfnA5が発現している頭頂葉から伸びた軸索は、ストライプに影響されること無く伸びることがわかりました(図3)。
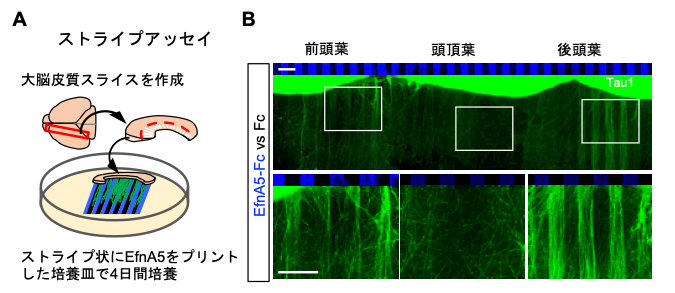
図3. 大脳皮質全長スライスを用いたストライプアッセイ
(A)生後0日のマウス脳より大脳皮質の前頭葉から後頭葉までの全長を含む組織スライスを作成し、EfnA5をストライプ状にプリントした基質上で培養を行った。
(B)EphA7の発現している前頭葉・後頭葉から伸びた軸索は、EfnA5のストライプを避けるように軸索が伸びた。EfnA5の発現が占める頭頂葉から伸びた軸索はストライプに影響されること無く伸長した。
そこでさらに、生体内の神経回路(皮質橋路)形成において実証するために、マウス胎児脳内での遺伝子操作技術を用いて、皮質橋路の回路形成における EphA7とEfnA5の機能解析を行いました。大脳皮質前頭葉でEphA7の発現を減らすと、そこから伸びた軸索は本来つながらないはずの橋核のEfnA5を発現している領域に侵入し、同様に、大脳皮質頭頂葉でEfnA5の発現を減らすと、そこから伸びた軸索は橋核のEphA7を発現する領域へと侵入しました(図4)。さらに、ゲノム編集技術を用いて作製したEphA7遺伝子の発現しないノックアウトマウスを調べると、橋核へ伸びる軸索側枝のつながり方が乱れることや、大脳皮質や橋核においてEfnA5を発現する領域が、本来EphA7の発現している領域にまで広がることがわかりました。
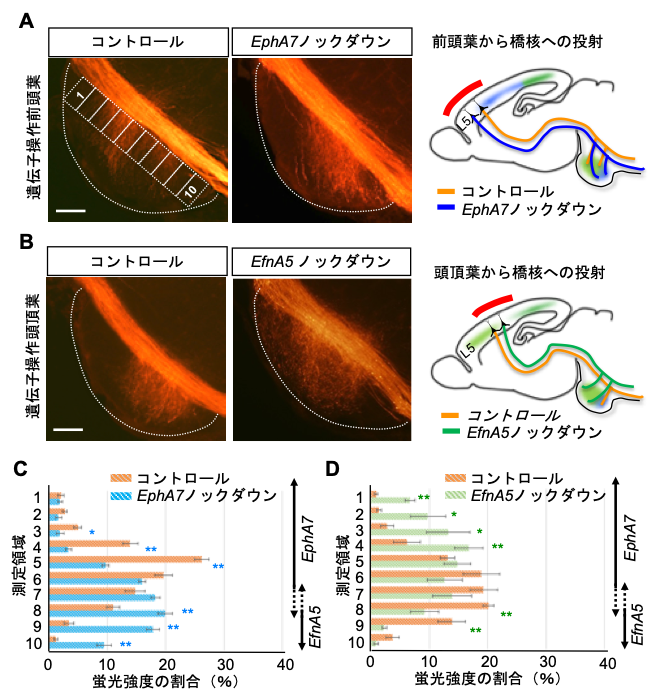
図4. EphA7とEfnA5のノックダウン実験
(A)大脳皮質前頭葉でEphA7の発現を抑えると(EphA7ノックダウン)、そこから伸びた軸索はEfnA5の発現している橋核の尾側領域に侵入した。
(B)大脳皮質頭頂葉でEfnA5の発現を抑えると(EfnA5ノックダウン)、そこから伸びた軸索はEphA7の発現する橋核の吻側領域へと侵入した。
(C)(A) の結果の定量データ。橋核を吻尾(前後)軸に沿って10領域に区分し、神経回路に発現させた蛍光タンパク質の蛍光強度を測定することで軸索側枝の投射領域を定量した(グラフ右側に、橋核でのEphA7とEfnA5の発現領域を示す)。コントロールと比較して、EphA7ノックダウンによりEfnA5発現領域に軸索側枝が侵入した。
(D)(B) の結果の定量データ。コントロールと比較して、EfnA5ノックダウンによりEphA7発現領域に軸索側枝が侵入した。
以上の結果から、EphA7とEfnA5が相互反発作用によって大脳皮質と橋核それぞれにおける機能領域の区分化を制御していること、さらに、区分化された領域同士の接続を制御し、正確な回路形成を可能にしていることがわかりました。
本研究成果が社会に与える影響(本研究成果の意義)
本研究成果により、大脳皮質と橋核をつなぐ神経回路は、相互排他的な分子のはたらきによって、機能領野ごとに区分された投射パターンを形成することが明らかになりました。このモデルは、単一の機能領野内の神経回路において、軸索ガイダンス分子の濃度勾配によって形成されるトポグラフィックな投射様式とは異なり、複数の機能領野ごとに区分された回路の形成様式を示すものです。EphA7とEfnA5でみられるような軸索ガイダンス分子の相互排他的な発現様式は霊長類にいたるまで種を超えて保存されており、本研究で示された、相互に反発する分子が脳の機能領野の区分と、機能領野ごとに区分された領域間の回路形成の誘導に働くという原理は、進化的にも保存され、なおかつ様々な脳領域間の接続に共通である可能性があります。本研究成果は、脳の配線である神経回路の不要な混線を防ぎ正確につなぐ仕組みの理解や、混線が原因となる運動機能障害などの病態解明、さらには傷害を受けた大脳皮質内および大脳皮質から伸びる神経回路に対する回路再構築による治療方法の開発につながることが期待されます。
特記事項
本研究成果は、米国科学誌「The Journal of Neuroscience」に6月3日(木)午前6時(日本時間)[6月2日(水)午後5時(米国東部時間)]に掲載されました。
【タイトル】 “Mutually repulsive EphA7-EfnA5 organize region-to-region corticopontine projection by inhibiting collateral extension”
【著者名】 Tokuichi Iguchi1,2,3, Yuichiro Oka1,2,4, Misato Yasumura1, Minoru Omi2, Kazuki Kuroda2, Hideshi Yagi2, Min-Jue Xie2,4, Manabu Taniguchi1, Martin Bastmeyer5, Makoto Sato1,2,4,6,7
【所属】
1.大阪大学 大学院医学系研究科 解剖学講座(神経機能形態学)
2.福井大学 医学部形態機能医科学講座組織細胞形態学・神経科学領域
3.福井医療大学 保健医療学部看護学科
4.大阪大学 大学院連合小児発達学研究科こころの発達神経科学講座(分子生物遺伝学)
5.カールスルーエ工科大学(Department of Cell and Neurobiology, Zoological Institute)
6.大阪大学 大学院生命機能研究科
7.福井大学 こどものこころの発達研究センター
なお、本研究は、科学研究費補助金基盤研究(B)、基盤研究(C)、若手研究(B)、挑戦的萌芽研究、による支援を受けて行われました。
用語説明
- EphA7(エフエー7)とEfnA5(エフリンエー5)
それぞれエフ受容体ファミリーとエフリンファミリーに属するタンパク質で、共に細胞膜に存在する。受容体とそれに結合するリガンドとして知られているが、シグナル伝達の方向は一方向ではなく両方向性に伝わる。つまり、隣り合った細胞にそれぞれの分子が発現し、結合した場合は、それぞれの分子を介して両方の細胞内に反発性のシグナルが伝達され、細胞は互いに離れるように働く。
- 皮質橋路
大脳皮質の様々な領域から出力して橋と呼ばれる脳領域の底部にある橋核に接続する回路。大脳皮質と小脳皮質を直接結ぶ神経回路はなく、この回路が両者の連関に重要な役割を果たす。橋核は大脳と小脳を結ぶ中継核として、小脳へと神経回路を接続する。大脳皮質からの運動指令のコピーを小脳に伝え、運動がなめらかに、正確に行うことができるように働く。また、大脳皮質からは運動野以外にも体性感覚野や視覚野からも神経回路が接続しており、運動機能以外にも様々な脳機能に関与していることが示唆されている。
- 機能領野
大脳皮質は、運動や体の感覚など、特定の機能を担う領域に区分されており、その区分された領域を機能領野とよぶ。また、大脳皮質と回路を作っている他の脳領域についても特定の機能に関係する領域ごとに区分されており、関連の強い機能領野と神経回路を形成している。視覚や嗅覚といった単一の機能領野と関連脳領域との結合では、軸索ガイダンス分子の濃度勾配にしたがったトポグラフィックな回路接続様式が知られているが、複数の機能領野からの出力回路が区分されて標的へ接続する仕組みはよくわかっていない。
- 軸索側枝
神経細胞は軸索と呼ばれる細長い一本の突起を伸ばし、他の神経細胞と接続することで脳内の神経回路が作られる。一部の軸索は、1対1ではなく、軸索の途中から“軸索側枝”とよばれる枝を伸ばすことで、複数の標的に回路を作ることができる。皮質橋路では、大脳皮質から脊髄へ伸びた皮質脊髄路軸索の途中から軸索側枝が橋核に伸び、橋核の神経細胞に接続することで回路が作られる。
