ハンチントン病の根本的治療へ道ひらける
核酸標的低分子による究極の遺伝子治療
研究成果のポイント
・根本的治療法のない神経難病であるハンチントン病の遺伝子異常を是正する低分子化合物を発見
・ハンチントン病の原因となる、塩基繰り返し配列の異常伸長を短縮させる方法を世界で初めて報告
・同じ塩基繰り返し配列の異常伸長が原因となる脊髄小脳失調症や筋強直性ジストロフィーへの応用も期待
・核酸を標的とする低分子創薬は日本が世界に先行する分野であり、今後製薬企業も一体となった治療開発に期待
概要
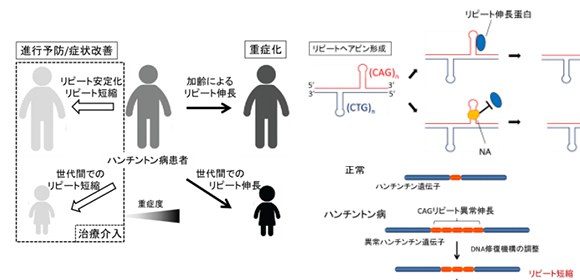
大阪大学大学院医学系研究科の中森雅之特任講師(常勤)、望月秀樹教授(神経内科学)、産業科学研究所の中谷和彦教授らの研究グループは、根本的治療法のない神経難病であるハンチントン病の遺伝子異常を是正する低分子化合物を発見しました。ハンチントン病 は、遺伝子上のCAG3塩基の繰り返し配列(リピート) が異常に伸びることが原因の神経変性疾患です。リピートが長ければ長いほど重症となることが知られており、患者さんの神経細胞でも徐々にリピートが伸びて症状の進行につながります (図1) 。こうしたリピートの伸長には、CAG繰り返し配列による特徴的なDNA構造 が関与すると考えられていました。
今回、中森特任講師らの研究グループは、中谷教授により創製された、CAGリピートが形成する特徴的なDNA構造に結合する核酸標的低分子化合物ナフチリジンアザキノロン(NA) に、異常に伸長したCAGリピートを短縮させる作用があることを見出しました。従来の遺伝子治療はウイルスベクターなどにより正常な遺伝子を導入して異常遺伝子の機能を補う方法が一般的ですが、本研究成果により、ハンチントン病の原因となる伸長したCAGリピートを短縮して正常化するという究極の遺伝子治療への道がひらけました。またこの治療法はCAGリピートの伸長が原因である脊髄小脳失調症 など他の神経疾患へも同じ原理で効果が期待されます。
本研究成果は、国際科学誌「Nature Genetics」に、2月15日(土)午前1時(日本時間)に公開されました。
図1 ハンチントン病のCAGリピート長変化
ハンチントン病では、異常伸長CAGリピートがさらに伸長し、症状の重症化につながります。治療介入により異常に伸長したリピートを短くすることができれば、症状の進行予防や改善が可能となります。
研究の背景
これまで、ハンチントン病や脊髄小脳失調症の一部は、CAGリピートの異常な伸長が原因で、これらのリピートはどんどん伸びて病状を悪化させる現象が知られていました。こうした疾患はいずれも神経難病で根本的治療法がなく、異常に伸びたリピートを短縮できるという発想すらありませんでした。
これまでに、大阪大学産業科学研究所の中谷教授らは、核酸標的低分子化合物ナフチリジンアザキノロン(NA)が、CAGリピートが形成する特徴的なDNA構造に結合することを明らかにしていました。
本研究の成果
研究グループでは、ハンチントン病などでCAGリピートが異常に伸長する際に、CAG繰り返し配列による特徴的なDNA構造をとることが関係していることに注目し、このDNA構造に結合する低分子化合物によってリピートを短縮できないかという仮説に基づき研究を進めてきました。CAG繰り返し配列による特徴的なDNA構造に強く結合する分子として、NAが、ハンチントン病モデル細胞、モデル動物でCAGリピートの短縮作用を示し、モデル動物での神経変性を抑制することを実証しました。このようなCAGリピートの短縮誘導には、生体に備わるDNA修復を介したメカニズムが考えられており (図2) 、核酸標的低分子をもちいてDNA修復機構を制御することで、究極の遺伝子治療が実現する可能性があります。
図2 核酸標的低分子化合物NAによるCAGリピートの短縮誘導メカニズム
リピートヘアピン形成とリピート伸長蛋白による作用(DNAの誤った修復)がリピートの伸長につながるとされています(左図)。NAによりリピート伸長蛋白の作用を抑えることで、リピート短縮につながります。こうして異常伸長リピートを短縮することができれば、遺伝子異常を正常化してハンチントン病の根本的治療につながることが期待できます(右図)。
本研究成果が社会に与える影響(本研究成果の意義)
本研究成果により、これまで治療法がなかったハンチントン病や脊髄小脳失調症などの神経難病の根本的治療法開発への道がひらけました。リピートが異常に伸長しておこる病気には、他にも筋萎縮性側索硬化症や筋強直性ジストロフィーなどがあり、これらの原因となる異常伸長リピート全般を対象とした核酸標的低分子化合物創薬にも期待がもてます。
特記事項
本研究成果は、2020年2月15日(土)午前1時(日本時間)に国際科学誌「Nature Genetics」(オンライン)に掲載されました。
【タイトル】“Slipped-CAG DNA binding small molecule induces trinucleotide repeat contractions in vivo ”
【著者名】Nakamori M 1 , Panigrahi GB 2 , Lanni S 2 , Gall-Duncan T 2,3 , Hayakawa H 1 , Tanaka H 1 , Luo J 2,3 , Otabe T 4 , Li JX 4 , Sakata A 4 , Caron MC 5,6 , Niraj J 5,6 , Prasolava T 2 , Chiang K 2,3 , Masson JY 5,6 , Wold MS 7 , Wang X 8 , Lee MYWT 8 , Huddleston J 9,10 , Munson KM 9 , Davidson S 2 , Layeghifard M 2 , Edward LM 2 , Gallon R 11 , Santibanez-Koref M 11 , Murata A 4 , Takahashi MP 1 , Eichler EE 9,10 , Shlien A 2 , Nakatani K 4 , Mochizuki H 1 , and Pearson CE 2,3
【所属】
1.大阪大学 大学院医学系研究科 神経内科学
2.トロント小児病院 Program of Genetics & Genome Biology
3.トロント大学 Program of Molecular Genetics
4.大阪大学 産業科学研究所 精密制御化学研究分野
5.ラバル大学病院 Québec Research Center, HDQ Pavilion, Oncology Division, Genome Stability Laboratory, CHU de
6.ラバル大学 Cancer Research Center, Department of Molecular Biology, Medical Biochemistry and Pathology
7.アイオワ大学 Department of Biochemistry, Carver College of Medicine
8.ニューヨーク医科大学 Department of Biochemistry and Molecular Biology
9.ワシントン大学 Department of Genome Sciences
10.ワシントン大学 ハワード・ヒューズ医学研究所
11.ニューカッスル大学 Institute of Genetic Medicine
なお、本研究は、JSPS科学研究費助成事業特別推進研究・基盤研究の一環として行われ、カナダ・The Hospital for Sick Children Christopher Pearson博士ら国際共同研究グループの協力を得て行われました。
研究者のコメント
核酸を標的とする低分子創薬は日本が世界に先行する分野であり、今後製薬企業も一体となって神経難病などに対する治療開発が進むことを期待しています。
参考URL
大阪大学 大学院医学系研究科 神経内科学HP
http://www.med.osaka-u.ac.jp/pub/neurol/myweb6/Top.html
用語説明
- ハンチントン病
ハンチンチン遺伝子のCAG3塩基繰り返し配列が異常に伸びておこる遺伝性の神経変性疾患で、舞踏運動などの不随意運動や精神症状、行動異常、認知障害などを呈します。現在のところ根本的な治療法は残念ながらありません。
- 脊髄小脳失調症
歩行時のふらつきや、手の震え、ろれつが回らないといった運動失調を症状とする神経の病気です。このなかで遺伝性のものがあり、塩基繰り返し配列の異常な伸長が原因のものには脊髄小脳失調症1型、2型、3型、6型、7型、8型、10型、17型、31型、36型や歯状核赤核淡蒼球萎縮症などが知られています。
- 繰り返し配列(リピート)
遺伝子上には塩基の繰り返し配列がいたるところに存在しています。これらのリピートが異常に伸長することがあり、なかには病気を引き起こすものがあります。具体的にはCAGリピートが原因となるハンチントン病、脊髄小脳失調症の一部や、CTGリピートが原因となる筋強直性ジストロフィーやフックス角膜ジストロフィー、CGGリピートが原因となる脆弱性X症候群、GGGGCCリピートが原因となる筋萎縮性側索硬化症などがあります。
- CAG繰り返し配列による特徴的なDNA構造
CAG繰り返し配列が異常に伸長することにより、本来のDNA二本鎖構造ではなく、CAG同士がくっついてヘアピン上のslipped strand構造をとります。CAGとCAG同士で二本鎖をつくりますが、A-Aの塩基でミスマッチ構造が生じ、このスペースにNAが結合すると考えられています。
- ナフチリジンアザキノロン(NA)
グアニン(G)と水素結合する「ナフチリジン」と、アデニン(A)と水素結合する「アザキノロン」の2つの構造を繋いだ「人工設計分子」。当初はG-Aミスマッチ塩基対に結合する分子として設計・創製した分子で、後日、CAG繰り返し配列が形成するヘアピン構造中のC-G塩基対で挟まれたA-Aミスマッチに結合することを発見した。
